Проекционные формулы Фишера
Поиск ЛекцийДля изображения на iплоскости молекул с асимметрическими атомами углерода часто используют проекции, предложенные в 18Э1 году Э. Фишером.
Рассмотрим принцип их построения на примере молекулы бромфторхлорметана. Исходным пунктом при построении проекций Фишеоа служитпространственная модель молекулы или ее клиновидная проекция.
Расположим молекулу таким образом, чтооы в плоскости чертежа остался только атом углерода молекулы бромфторхлорметана, как это показано на рисунке:
Спроектируем на плоскость чертежа все атомы (Вг и CL снизу вверх, так как они расположены под плоскостью чертежа, а F и H- сверху вниз). Для того, чтобы полученная проекция отличалась от структурной формулы, условимся не изображать асимметрический атом углерода. Он подразумевается
Как видно из приведенного примера, проекция Фишера строится таким образом, чтобы связи асимметрического атома с заместителями изображались вертикальными и горизонтальными (но не наклонными!) линиями.
При пользовании проекциями Фишера важно помнить, что вертикальная линия в них изображает связи, удаляющиеся от нас, а горизонтальная линия — связи, направленные к нам. Отсюда вытекают правила пользования проекциями Фишера:
НЕЛЬЗЯ:
1) Нельзя выводить проекцию из плоскости чертежа (например,просматривать ее «на просвет*, то есть с другойсторонылиста).
2) Нельзя поворачивать проекцию вплоскости чертежа на 90° и 270°.
3) Нельзя менять местами два любых заместителя при асимметрическом атоме.
МОЖНО:
1)Можно поворачивать проекцию в плоекостй чертежа на 180°. При таком повороте вертикальные линииостаются вертикальными, а горизонтальные — горизонтальными.
2)Можно производить четное число парных перестановок заместителей при асимметрическом атоме.
3) Можнопроизводить круговую перестановку трех заместителей при асимметрическом атоме. Четвертый заместитель при этом остается на своем месте.
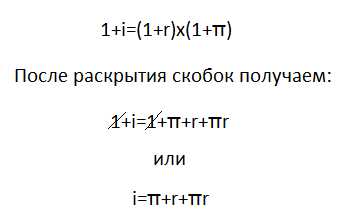
N52
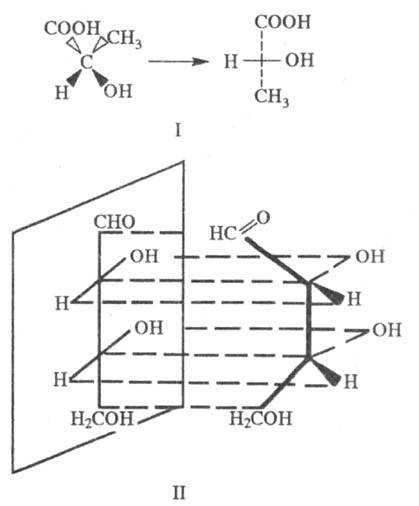
Асимметрический атом углерода связан с четырьмя неэквивалентными группами в молекуле глюкозы к числу таких атомов принадлежат атомы углерода с номерами от 1 до 5
Антиподы
вещество, характеризующееся противоположными по знаку и одинаковыми по величине вращениями плоскости поляризации света при идентичности всех других физических и химических свойств (за исключением реакций с другими оптически активными веществами и физических свойств в хиральной среде)
Рацемат — эквимолярная смесь двух энантиомеров(Энантиомеры (др.-греч. ἐνάντιος + μέρος — противоположный + часть, мера) — пара стереоизомеров, представляющих собой зеркальные отражения друг друга, не совмещаемые в пространстве). Рацематы не обладают оптической активностью, а также отличаются по свойствам от индивидуальных энантиомеров. Являются продуктами нестереоселективных реакций
Типы рецаматов
· Рацемический конгломерат представляет собой механическую смесь кристаллов двух энантиомеров соотношением 1:1, при этом каждый кристалл состоит из молекул только одного энантиомера.
· Рацемическое соединение (истинный рацемат) состоит из кристаллов, в каждом из которых находятся молекулы обоих энантиомеров и их соотношение равно 1:1. Такое соотношение энантиомеров в рацемических соединениях сохраняется до уровня кристаллической решётки.
· Псевдорацемат
является твёрдым раствором двух энантиомерных соединений, то есть представляет собой гомогенную разупорядоченную смесь энантиомеров соотношением 1:1.Физические свойства
· Оптическая активность. Рацематы не проявляют оптической активности, то есть не вращают плоскость поляризации света[1]. Данное явление объясняется тем, что для энантиомеров оптическое вращение противоположно по знаку, но равно по величине. Поскольку вращение является аддитивной величиной, в случае рацемата из-за компенсации вкладов энантиомеров оно равняется нулю.
· Форма кристаллов. Поскольку энантиомеры образуют энантиоморфные кристаллы, рацемические конгломераты существуют в виде двух типов кристаллов, которые по форме являются зеркальными отражениями друг друга. Именно этот факт позволил Л. Пастеру вручную разделять кристаллы рацемических тартратов[6].
· Плотность
· Температура плавления. Для рацемического конгломерата температура плавления всегда ниже температуры плавления индивидуальных энантиомеров, что видно по его диаграмме состояния. Например, энантиомерно чистый гексагелицен плавится при 265—267 °С, а рацемат — при 231—233 °С[8].
Если рацемат является истинным, что характерно для большинства органических рацематов, то температура его плавления может быть как выше, так и ниже температуры плавления энантиомеров. Так, в случае диметилтартрата температуры плавления чистого энантиомера и рацемата равны соответственно 43,3 °С и 86,4 °С. Рацемат миндальной кислоты, напротив, плавится при более низкой температуре, чем энантиомерно чистое вещество (118,0 °С и 132,8 °С соответственно). Добавление индивидуального энантиомера к истинному рацемату всегда приводит к понижению температуры плавления, в отличие от того, что наблюдается для конгломератов [9].
В редких случаях, когда рацематы проявляют свойства твёрдых растворов, они плавятся при той же температуре, что и индивидуальные энантиомеры (для камфоры — ≈178 °С)[10].
· Растворимость. Для большинства хиральных соединений характерны различия в растворимости рацемата и индивидуальных энантиомеров. Растворимость рацемических конгломератов выше растворимости чистых энантиомеров. Эмпирическое правило Мейерхоффера, применимое к недиссоциирующим органическим соединениям, гласит, что растворимость рацемата вдвое больше растворимости энантиомеров. Для истинных рацематов растворимость может быть больше или меньше растворимости энантиомеров
N53


Реакции моносахаридов

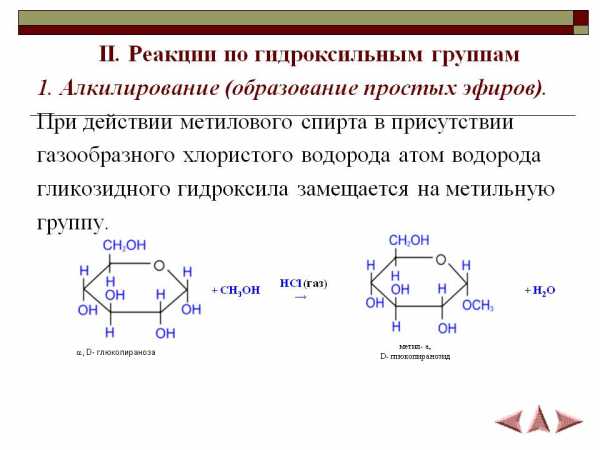
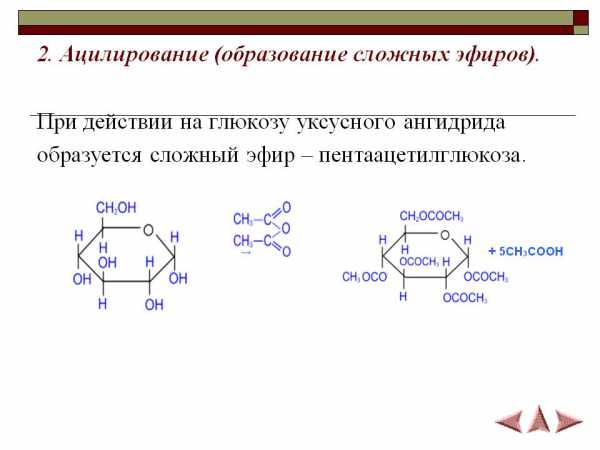
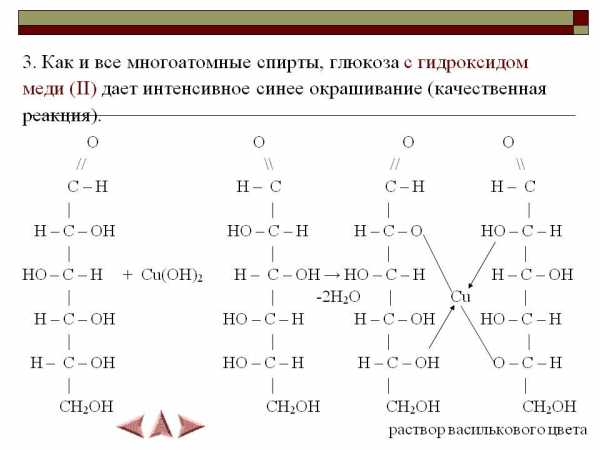



N54
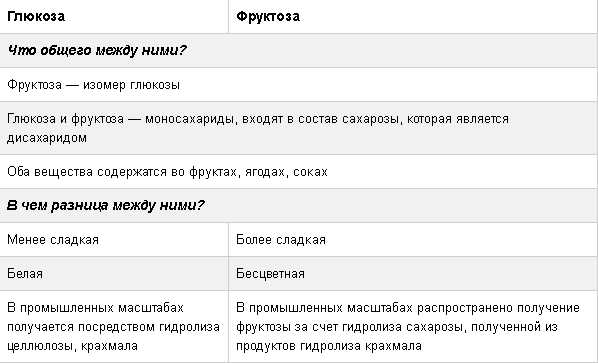
Глюко́за, или виноградный сахар
, или декстроза (D-глюкоза), С6H12O6 — встречается в соке многих фруктов и ягод, в том числе и винограда, от чего и произошло название этого вида сахара. Является моносахаридом и шестиатомным сахаром (гексозой). Глюкозное звено входит в состав полисахаридов (целлюлоза, крахмал, гликоген) и ряда дисахаридов (мальтозы, лактозы и сахарозы), которые, например, в пищеварительном тракте быстро расщепляются на глюкозу и фруктозу.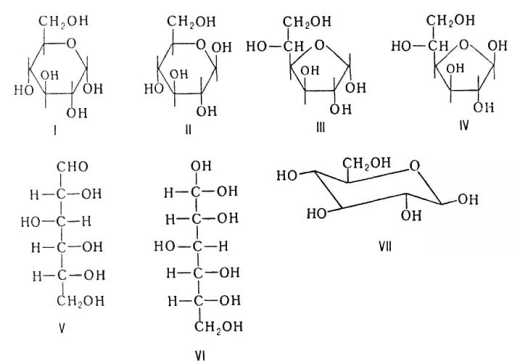

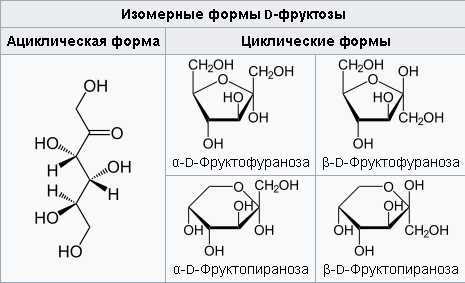
D-Фруктоза
Получают в виде β-формы. Очень гигроскопичные бесцветные призмы или иглы. tпл. 103-105 (разлагается).
Удельное оптическое вращение для D-линии натрия при температуре 20°С: [α]D20 -132,2 → -92,4 (с=4 в Н2О).
Растворимость: 37520, 74055 в Н2
Безводная форма устойчива при температуре > 21,4 °С. Способна гидратироваться с образованием полугидрата (и дигидрата) при температуре < 20°С. Перекристаллизовать из МеОН. Положительная реакция Селиванова. Кристаллический сахар — β-D-пираноза, но в растворе содержится ≥ 15% фуранозной формы и значительное количество открытой линейной формы. В составе соединений найдена только фуранозная форма. Сладкий вкус.
Аскорби́новая кислота́ (от др.-греч. ἀ — не- + лат. scorbutus — цинга) — органическое соединение с формулой C6H8O6, является одним из основных веществ в человеческом рационе, которое необходимо для нормального функционирования соединительной и костной ткани. Выполняет биологические функции восстановителя и кофермента некоторых метаболических процессов, является антиоксидантом. Биологически активен только один из изомеров — L-аскорбиновая кислота, который называют витамином C. В природе аскорбиновая кислота содержится во многих фруктах и овощах[3].
Гликози́ды — органические соединения, молекулы которых состоят из двух частей: углеводного (пиранозидного или фуранозидного) остатка и неуглеводного фрагмента (т. н. агликона). В качестве гликозидов в более общем смысле могут рассматриваться и углеводы, состоящие из двух или более моносахаридных остатков. Преимущественно кристаллические, реже аморфные вещества, хорошо растворимые в воде и спирте.
Гликозиды представляют собой обширную группу органических веществ, встречающихся в растительном (реже в животном) мире и/или получаемых синтетическим путём. При кислотном, щелочном, ферментативном гидролизе они расщепляются на два или несколько компонентов — агликон и углевод (или несколько углеводов). Многие из гликозидов токсичны или обладают сильным физиологическим действием, например, гликозиды наперстянки, строфанта и другие.
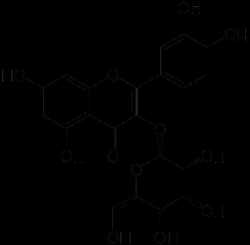
N55
Фруктоза (фруктовый сахар), C6H12O6 — моносахарид, кетоноспирт, кетогексоза, изомер глюкозы.
Физические свойства
Белое кристаллическое вещество, хорошо растворимое в воде. Температура плавления фруктозы ниже температуры плавления глюкозы. В 2 раза слаще глюкозы и в 4-5 раз слаще лактозы.
Химические свойства
В водных растворах фруктоза существует в виде смеси таутомеров, в которой преобладает β-D-Фруктопираноза и содержится, при 20 °C, около 20 % β-D-Фруктофуранозы и около 5 % α-D-Фруктофуранозы
В отличие от глюкозы и других альдоз, фруктоза неустойчива как в щелочных, так и кислых растворах; разлагается в условиях кислотного гидролиза полисахаридов или гликозидов
Рекомендуемые страницы:
Поиск по сайту
poisk-ru.ru
Фишера формулы — Справочник химика 21
Фишера формула — открытая форма моносахарида (глюкозы). [c.497]НОМЕНКЛАТУРА СТЕРЕОХИМИЧЕСКАЯ, предназначена для обозначения строения молекул пространств, изомеров. Для обозначения энантиомеров пользуются В, Ь- или Я, З-номенклатурой. В первом случае конфигурацию соед. (аминокислоты, оксикислоты, сахара), имеющих в Фишера формуле амино- или оксигруппу слева, обозначают знаком справа — В (рис. 1). В К, З-системе прежде всего опре- [c.390]
Фишера формулы (проекции Фишера) — способ изображения на плоскости пространственных структур молекул, имеющих хиральные центры. Проекции Фишера применимы для соединений с несколькими хи-ральными центрами, в том числе и дпя молекул, изображение которых в трехмерном пространстве затруднено. [c.324]
Поскольку левовращающая фруктоза образуется из правовращающей глюкозы, то, согласно Фишеру, формула этой фруктозы должна быть [c.77]
ФИШЕРА ФОРМУЛЫ, изображение на плоскости пространств. структур соед. с асимметрич. атомами. При построении ф-л для соед. с одним асимметрич. атомом (А. а.) на плоскость проектируют модель молекулы, к-рую условно располагают так, чтобы А. а. находился в плоскости чертежа, заместители, расположенные слева и справа,— перед плоскостью, а заместители вверху и внизу — за плоскостью чертежа (связи этих заместителей с А. а. иногда изображают пунктирной линией). Цепь молекулы с неск, А. а. располагают в пространстве вертикально в виде равномерно вы- [c.622]
Следовательно, расчетное значение критерия Фишера (формула (7.1.2.6)) будет р = 3,416, а число степеней свободы, связанное с оценкой дисперсии адекватности, составит Уад = 2. Табличное значение критерия Фишера (см. табл. 7.1.2.3), соответствующее числу степеней свободы числителя 8 и числу степеней свободы знаменателя 2 при а = 0,05, равно Р 19,3. Поскольку Р> Fp, то, согласно условию (7.1.2.8), найденную математическую модель следует признать адекватной. [c.615]
Этими способами были получены все четыре возможных этиопорфирина, различающиеся между собой положением метильных и этиль-ных боковых цепей. Согласно Г. Фишеру, формулы этих соединений мо- [c.975]
Для получения проекции Фишера формулу ориентируют так, чтобы асимметрический атом углерода находился в плоскости чертежа. Затем углеродную цепь расгюлагают за плоскость чертежа с севера на юг (вверху должен находиться атом углерода, имеющий первый номер при названии соединения по международной номенклатуре). Мысленно молекулу сплющивают и получают проекционную формулу. См. также [2], I, с. 132 [c.220]
В зависимости от характера пространств, расположения заместителей М. могут иметь ра.зл. стереохим. конфигурации (изображаемые, напр., Фишера формулами), с чем связаны явления оитич, и геом. изомерии и др. С возможностью разл. пространств, ориентации отд. частей М. друг относительно друга связано понятие о конформациях (изображаемых, напр., Ньюмена формулами). Наглядное представление о пространств, строении М. дают Дрейдинга модели, Стюарта — Бриглеба модели и др. Многие св-ва М. непосредственно зависят от их симметрии (см. Симметрия молекул). [c.346]
www.chem21.info
Пространственные формулы Фишера — Справочник химика 21
Конфигурацию протеиногенных аминокислот соотносят с о-глюкозой такой подход предложен Э. Фишером в 1891 г. В пространственных формулах Фишера заместители у хирального С-2 атома занимают положение, которое соответствует их абсолютной конфигурации (это было доказано через 60 лет). [c.26]ПРОСТРАНСТВЕННЫЕ ФОРМУЛЫ ФИШЕРА [c.308]
Существование пары оптических антиподов — проявление пространственной изомерии (стереоизомерии) молочной кислоты. С помощью проекционных формул Фишера строение оптических антиподов молочной кислоты изображается так [c.263]
Используя пространственную формулу правовращающей глюкозы в качестве опорной точки и обозначив пространственную конфигурацию, присущую этому веществу, знаком с1, Э. Фишер предложил относить к -ряду все соединения, которые можно получить из правовращающей глюкозы, например [c.296]
Фишеровские проекции. Для того чтобы выяснить отношения между относительной и абсолютной конфигурацией, необходимо сначала ознакомиться с изображением на плоскости (в двух измерениях) стереохимических формул, которые имеют пространственный смысл (три измерения). Приводим два способа изображения. Слева (формула а и 16) — это, по существу, перспективный рисунок, который мало применим для случаев с многими асимметрическими атомами, справа — проекционные формулы Фишера (Па и б) [c.383]
Поскольку на тетраэдр можно смотреть с разных сторон, одна модель может дать 12 внешне непохожих формул Фишера. Чтобы получить правильные результаты, необходимо помнить, что формулы Фишера являются проекциями на плоскость, и их нужно рассматривать иначе, чем пространственные модели. Поэтому вводится ряд ограничений. Формулу нельзя выводить из плоскости чертежа и нельзя поворачивать на 90 , хотя поворот на 180° допустим [c.36]
Имея в виду пространственную ориентацию вертикальных и горизонтальных линий связей в проекционной формуле Фишера, с этой формулой можно обращаться как с тетраэдрической моделью и определять по ней тин энантиомера в / ,5-номенклатуре. Существует и более формализованная процедура определения абсолютной конфигурации по формуле Фишера. [c.191]
Конформации моносахаридов Формулы Хеуорса, несмотря на преимущества по сравнению с формулами Фишера, все-таки не отражают истинного пространственного строения циклических форм моносахаридов Если пятичленный цикл близок к плоской форме и формулы Хеуорса достаточно удовлетворительно описывают строение фураноз, то пиранозы имеют в основном конформацию кресло [c.762]
Формулы Фишера не отражают точно пространственное расположение молекулы в циклической форме. Например, в случае цикли- [c.106]
Циклические формулы в том написании, которым мы пользовались до сих пор проекционные формулы Фишера), недостаточно наглядно передают пространственное строение молекулы. Гораздо нагляднее иной способ написания с нормальным обозначением пяти- или шестичленного кольца. [c.371]
Обозначения D- я L- в названиях гидроксикислот указывают условно НХ конфигурацию, т. е. пространственное расположение заместителей вокруг асимметрического атома углерода. Обозначение D- получают те гидроксикислоты, у которых гидроксильная группа в проекционной формуле Фишера стоит справа обозначение L-ставится, если гидроксильная группа в проекционной формуле оказывается слева. [c.323]
Формула Фишера Формула Хеуорса В циклических формах моносахаридов появляется еще один асимметрический атом углерода (С-1 у альдоз и С-2 у кетоз). Этот асимметрический атом углерода называется аномерным. Изомеры углеводов, отличающиеся расположением атомов и атомных групп у аномерного атома углерода, называются аномерами. Стереоизомер (пространственный изомер), в котором группа —ОН у аномерного атома С располагается под плоскостью цикла, называется а-аномером, а стереоизомер с противоположным расположением ОН-группы называется Р-аномером [c.664]
Для изображения на бумаге конфигурации таких молекул в настоящее время применяют предложенные Фишером так называемые проекционные формулы, Для этого связанные в цепи углеродные тетраэдры представляют в виде развернутой прямой линии, приче.м все имеющиеся группы располагаются над плоскостью бумаги атомные группы, связанные с углеродными атомами, при этом оказываются вправо и влево от прямой, на которой находятся углеродные ато.мы. Проекция всех групп па бумагу позволяет представить их взаимное пространственное расположение. [c.140]
Пространственное строение оптических антиподов мы выражали до сих пор лишь с помощью рисунков или проекционных формул по Фишеру, однако еще не научились давать им названия. Между тем формулы можно употреблять далеко не всегда — их нельзя применять в устной речи, нельзя включить в алфавитном порядке в словари, справочники. Любой предмет, в том числе и оптический антипод, должен иметь свое название в данном случае название должно отражать особенности пространственного строения молекул. [c.64]
Результаты анализов указывают на то, что данное вещество — Д-фруктоза, составная часть тростникового сахара. Ее пространственное строение в открытой (нециклической) форме можно изобразить с помощью проекционной формулы по Фишеру. [c.175]
Фишера формулы (проекции Фишера) — способ изображения на плоскости пространственных структур молекул, имеющих хиральные центры. Проекции Фишера применимы для соединений с несколькими хи-ральными центрами, в том числе и дпя молекул, изображение которых в трехмерном пространстве затруднено. [c.324]
Э. Фишер предложил следующий способ изображения пространственного строения оптических изомеров молекул на плоскости. Для написания проекционной формулы тетраэдрическую модель молекулы (рис. 79, а) располагают так, чтобы рассматриваемый асимметрический атом углерода лежал в плоскости чертежа, связи С —Ь и С —с лежали в горизонтальной плоскости, выступая на нас из плоскости чертежа. При этом связи С —а и С —(1 располагаются в вертикальной плоскости, уходя за плоскость чертежа (рис. 79, б). Видимую в таком положении картину проецируют на вертикальную плоскость (рис. 79, в). Схема обратного перехода от фишеровских формул к тетраэдрической модели заключается в том, что связи, образуемые асимметрическим атомом с группами Ь и с (находящимися в горизонтальной плоскости), считаются направленными вперед, выступают из плоскости бумаги, а связи с группами а и (1 (находящимися в вертикальной плоскости) как бы уходят за плоскость бумаги. Проекционные формулы, отвечающие одному из оптических изомеров, нельзя выводить из плоскости чертежа, поворачивать в плоскости на 90 и 270° и
www.chem21.info
Фишера формулы проекции Фишера — Справочник химика 21
В проекционных формулах Фишера применяют специальные условности и ограничения. Хиральный атом углерода, лежащий в центре на плоскости бумаги, связан направо и налево с атомами или группами, которые рассматриваются как направленные к наблюдателю, а атомы и группы, связи к которым идут от хирального атома вверх и вниз, рассматриваются как идущие за плоскость бумаги. Главная цепь, если она имеется, располагается вертикально атом, имеющий наименьший локант, помещается наверху. Так, соединение (11) в проекции Фишера изображается как (11а). [c.155]
Фишера формулы (проекции Фишера) — способ изображения на плоскости пространственных структур молекул, имеющих хиральные центры. Проекции Фишера применимы для соединений с несколькими хи-ральными центрами, в том числе и дпя молекул, изображение которых в трехмерном пространстве затруднено. [c.324]
Правила ШРАС по номенклатуре углеводов выработаны для того, чтобы, во-первых, дать название родоначальному моносахариду в ациклической форме, представленной проекцией Фишера, затем назвать циклическую форму и производные. Тщательно изучите прежде всего ациклические формы. Поскольку все углеводы имеют по крайней мере один хиральный центр, совершенно необходимо правильно использовать проекционные формулы Фишера. [c.231]
Для правильного расположения молекулы углевода необходимо так преобразовать проекцию Фишера, чтобы связи атомов углерода с эндоциклическим кислородом были направлены по вертикали. В формуле I это достигается одновременным циклическим поворотом всех заместителей у атома Св, что, как известно, не изменяет конфигурации. Далее следует расположить цикл горизонтально, поместив кислород в правый дальний угол, и разместить заместители таким образом, чтобы группы, стоящие в формуле [c.143]
Моносахариды часто претерпевают внутримолекулярную конденсацию карбонильной группы и ОН-группы у более отдаленного от функциональной группы атома углерода. При этом образуется циклический полу-ацеталь или полукеталь для альдоз и кетоз соответственно. На примере глюкозы эти структуры можно представить в следующем виде в линейной формуле Фишера после перестановок заместителей у пятого атома углерода все находящиеся слева заместители окажутся над плоскостью кольца в циклической формуле Хеуорса, а находящиеся справа заместители -под плоскостью. В результате появляются так называемые а-аномеры (у С-1 ОН-группа находится под плоскостью) и Р-аномеры (у С-1 ОН-груп-па находится над плоскостью). Схема перехода от линейных проекций Фишера к циклическим структурам Хеуорса показана на рис. 25. [c.66]
Проекционные формулы Фишера. Для изображения энантиомеров на плоскости используют проекционные формулы Фишера, называемые иногда просто проекциями Фишера. На плоскость бумаги проецируется тетраэдр. В зависимости от того, как он повернут в трехмерном пространстве и каким его видит наблюдатель, для одного и того же соединения может быть получено несколько проекций. Поэтому руководствуются определенными правилами. Углеродную цепь располагают вертикально таким образом, чтобы вверху оказалась старшая группа. Например, у гидроксикислот (см. рис. 3.14, а) принято располагать тетраэдр так, что наверху оказывается карбоксильная группа, а на горизонтальном ребре, повернутом к наблюдателю, располагаются атом водорода и гидроксильная группа (или галогены, аминогруппа и т. п. у других гетерофункциональных кислот). Хираль-ный атом углерода, находящийся в центре тетраэдра, переносится на плоскость в точку пересечения горизонтальной и вертикальной линий и не обозначается символом. Расположенные по горизонтали заместители направлены к наблюдателю, а по вер- [c.73]
Формула Фишера — это проекция заместителей на плоскость листа [c.152]
Положение заместителей в монозах указывается с помощью формул (проекций) Фишера (1) или перспективных формул Хеуорса (2) [c.159]
Проведем теперь систематическое построение этим методом (циангидриновый метод) всех возможных тетроз, пентоз и гексоз, исходя из одного из Энантиомеров глицеринового альдегида. Выберем за исходный (- -)-1>-глицериновый альдегид. Краткости ради в
www.chem21.info
Фишера формулы формил — Справочник химика 21
Сахара содержат несколько хиральных центров, и различным диастереомерам даны разные названия. Так, глюкоза, манноза и галактоза— это попросту три из восьми возможных диастереомерных альдо-гексоз (другими являются аллоза, альтроза, гулоза, идоза и талоза) [6]. Каждый из этих сахаров представлен парой форм (энантиоме-ров)—О и Ь, являющихся зеркальным отображением одна другой. Для иллюстрации взаимоотношений между сахарами часто пользуются проекционными формулами Фишера (разд. А.4), как это показано на рис. 2-13. Проекционные формулы удобны для сопоставления структур сахаров, но они дают весьма смутное представление о их трехмерной структуре. Согласно указанию Фишера, вертикальные связи при каждом атоме углерода следует представлять уходящими за данный атом. В действительности молекула такую конформацию иметь не может. Сравните, например, трехмерную структуру рибита (разд. А.6), образующегося при восстановлении глюкозы, с его формулой Фишера. [c.108]
Фишера формула — открытая форма моносахарида (глюкозы). [c.497]
Результаты анализов указывают на то, что данное вещество — Д-фруктоза, составная часть тростникового сахара. Ее пространственное строение в открытой (нециклической) форме можно изобразить с помощью проекционной формулы по Фишеру. [c.175]
Правила ШРАС по номенклатуре углеводов выработаны для того, чтобы, во-первых, дать название родоначальному моносахариду в ациклической форме, представленной проекцией Фишера, затем назвать циклическую форму и производные. Тщательно изучите прежде всего ациклические формы. Поскольку все углеводы имеют по крайней мере один хиральный центр, совершенно необходимо правильно использовать проекционные формулы Фишера. [c.231]
Перспективные формулы Хеуорса Недостатки проекционных формул Фишера очевидны и связаны, во-первых, с неестественным изображением связи, образуемой атомом кислорода в цикле, во-вторых, с далеким от наглядности и действительной геометрии изображением циклической формы моносахаридов Хеуорс предложил изображать циклические формы моносахаридов в виде плоских шести- и пятичленных колец [c.760]
Взаимосвязь проекционных формул Фишера открытых цепей сахаров и формул Хеуорса кольцевых форм сахаров показана ниже на примере о-глюкозы и ее пиранозной кольцевой формы. [c.123]
Более целесообразной формой записи проекционных формул Фишера представляются формулы (116) и в особенности (Ив). Их преимущество, во-первых, в том, что они наглядно изображают ту ориентацию заместителей относительно плоскости чертежа, о которой речь была в предыдущем абзаце. Во-вторых, именно условная (без изображения самих асимметрических атомов) форма записи (Ив) наглядно свидетельствует [c.155]
Циклические формы моносахаридов принято изображать в перспективных формулах, предложенных У. Хеуорсом. Например, пиранозная форма О-глюкозы в формулах Э. Фишера и У. Хеуорса. [c.449]
Конформации моносахаридов Формулы Хеуорса, несмотря на преимущества по сравнению с формулами Фишера, все-таки не отражают истинного пространственного строения циклических форм моносахаридов Если пятичленный цикл близок к плоской форме и формулы Хеуорса достаточно удовлетворительно описывают строение фураноз, то пиранозы имеют в основном конформацию кресло [c.762]
От названий эритрозы и треозы произошли терминологические приставки эритро-ч трео-, употребляющиеся для обозначения относительного расположения одинаковых (или родственных) заместителей у двух хи()альных атомов углерода. Если в проекционной формуле Фишера эти заместители находятся по одну сторону углеродной цепи, то такой стереоизомер называют эритро-формой, если по разные — то трео-формой. [c.78]
Циклические таутомерные формы этих трех сахаров изображены ниже в проекциях Фишера и в перспективных формулах Хеуорса (в этих формулах плоскость шестичленного цикла следует рассматривать как лежащую перпендикулярно плоскости рисунка). Асимметр
www.chem21.info
Фишера проекции формулы — Справочник химика 21
В проекционных формулах Фишера применяют специальные условности и ограничения. Хиральный атом углерода, лежащий в центре на плоскости бумаги, связан направо и налево с атомами или группами, которые рассматриваются как направленные к наблюдателю, а атомы и группы, связи к которым идут от хирального атома вверх и вниз, рассматриваются как идущие за плоскость бумаги. Главная цепь, если она имеется, располагается вертикально атом, имеющий наименьший локант, помещается наверху. Так, соединение (11) в проекции Фишера изображается как (11а). [c.155]
Правила ШРАС по номенклатуре углеводов выработаны для того, чтобы, во-первых, дать название родоначальному моносахариду в ациклической форме, представленной проекцией Фишера, затем назвать циклическую форму и производные. Тщательно изучите прежде всего ациклические формы. Поскольку все углеводы имеют по крайней мере один хиральный центр, совершенно необходимо правильно использовать проекционные формулы Фишера. [c.231]
Для правильного расположения молекулы углевода необходимо так преобразовать проекцию Фишера, чтобы связи атомов углерода с эндоциклическим кислородом были направлены по вертикали. В формуле I это достигается одновременным циклическим поворотом всех заместителей у атома Св, что, как известно, не изменяет конфигурации. Далее следует расположить цикл горизонтально, поместив кислород в правый дальний угол, и разместить заместители таким образом, чтобы группы, стоящие в формуле [c.143]
На рис. 81 изображены все четыре стереоизомера в боковых проекциях, соответствующих им плоских проекциях (проекционные формулы Э. Фишера) и формулах Ньюмена. Приведены нестабильные заслоненные конформации, которые соответствуют изображенным проекциям, и рядом один из стабильных конформеров. [c.228]
Сформулируйте правила составления проекционных формул энантиомеров по Э. Фишеру и правила обращения с ними на бумаге. Приведите фишеровские проекции для соединений, указанных в задаче 219. [c.35]
Это противоречие впервые объяснил Э Фишер, который, используя стереохимические представления Вант-Гоффа, определил относительные конфигурации ряда моносахаридов (глюкозы, фруктозы, маннозы, арабинозы) Графическое изображение пространственных конфигураций моносахаридов в открытой форме, например, методом проекции формул Э Фишера, имеет следующий вид [c.754]
Моносахариды часто претерпевают внутримолекулярную конденсацию карбонильной группы и ОН-группы у более отдаленного от функциональной группы атома углерода. При этом образуется циклический полу-ацеталь или полукеталь для альдоз и кетоз соответственно. На примере глюкозы эти структуры можно представить в следующем виде в линейной формуле Фишера после перестановок заместителей у пятого атома углерода все находящиеся слева заместители окажутся над плоскостью кольца в циклической формуле Хеуорса, а находящиеся справа заместители -под плоскостью. В результате появляются так называемые а-аномеры (у С-1 ОН-группа находится под плоскостью) и Р-аномеры (у С-1 ОН-груп-па находится над плоскостью). Схема перехода от линейных проекций Фишера к циклическим структурам Хеуорса показана на рис. 25. [c.66]
Необходимо напомнить, что по предложению Э. Фишера конфигурационные формулы являются проекциями молекул при определенном положении их частей, а именно при расположении углеродной цепи в виде дуги, обращенной вогнутой частью к плоскости, на которую падает проекция, а выпуклой — к наблюдателю (рис. 3 б). [c.17]
Формула Фишера — это проекция заместителей на плоскость листа [c.152]
В соответствии с 5п -системой глицерин должен изображаться в виде проекции Фишера, как это сделано на формуле (55), с центральной ОН-группой, проектируемой во в
www.chem21.info
понимаем лучше экономику и финансы
25 дек 2013 Сергей Кикевич Все авторы
В 1911 году американский финансист Ирвинг Фишер в своей книге «Покупательная сила денег» опубликовал результат своих наблюдений за инфляцией, денежной массой и объемом производства в виде простой но очень емкой формулы:
M V = P Q
М – объем денежной массы
V – скорость оборачиваемости денег
P – уровень цен
Q – объём производства
С тех пор эта формула используется повсеместно для анализа финансовой ситуации и в целях формирования монетарной политики.
Использование формулы Фишера
Уравнение может иметь несколько интерпретаций. Одна из них, возможно, наиболее важная:
При увеличении денежной массы (левая сторона уравнения) возможным результатом может стать как рост объема производства и товаров на рынке, так и рост уровня цен (правая сторона уравнения).
В реальной жизни могут происходить оба явления, но в разных пропорциях. И эти пропорции довольно качественно характеризуют свойства экономики. В развитых странах, где ВВП в основном складывается из промышленных и высоко технологичных продуктов и услуг, рынок спокойно «съедает» очередную порцию денег, напечатанную государством, без значительного роста цен. «Лишние» деньги, которые не может осовоить экономика напрямую, уходят в другие виды долгосрочных активов: акции, облигации, взаимные фонды, пенсионные накопления и т.п.
В других странах, зависящих от природных ресурсов с низкой зависимостью ВВП от реального сектора, наблюдается обратное явление. Сколько денег в экономику не вкачивай, на производство это не оказывает ни малейшего влияния.
Уравнение Фишера и ситуация с денежной массой в России
Становится довольно понятно, почему опыт США с их «количественным смягчением» и колоссальным вливанием новых денег в экономику не получается применить в России.
Со времен Кудрина Минфин и ЦБ взяли обязательство контролировать инфляцию доступными для них методами, в т.ч. ограничивая денежную массу. До этого, кажется, в нашей стране никто уравнение Фишера не изучал. Тем не менее даже сейчас регулярно слышатся призывы (в основном от политиков левого толка) вроде «давайте напечатаем денег и оживим экономику». Разобравшись в смысле уравнения Фишера, становится очевидным, почему простое печатание денег никогда не приводит к желаемым эффектам.
Понравилась статья?
Самое интересное и важное в нашей рассылке
Анонсы свежих статей Информация о вебинарах Советы экспертов
Нажимая на кнопку «Подписаться», я соглашаюсь с политикой конфиденциальности
rostsber.ru
