это что за вещество? Свойства, получение и применение метанола
В отличие от углеводородов, кислородсодержащие органические вещества имеют комплекс атомов, называемый функциональной группой. Метанол – это предельный спирт, имеющий в составе своей молекулы гидроксильную группу. Она и определяет основные характеристики данного соединения. В нашей статье мы рассмотрим способы получения метилового спирта, важнейшие химические реакции и применение метанола.
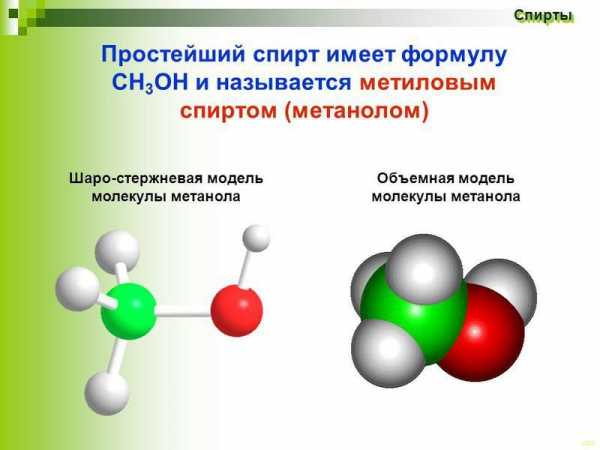
Строение молекулы
Для того чтобы выяснить строение метилового спирта, нужно вспомнить, какой вид имеет молекула простейшего предельного углеводорода – метана. Она выражается формулой CH4 и содержит один атом карбона, связанный с помощью простых сигма-связей с атомами водорода.

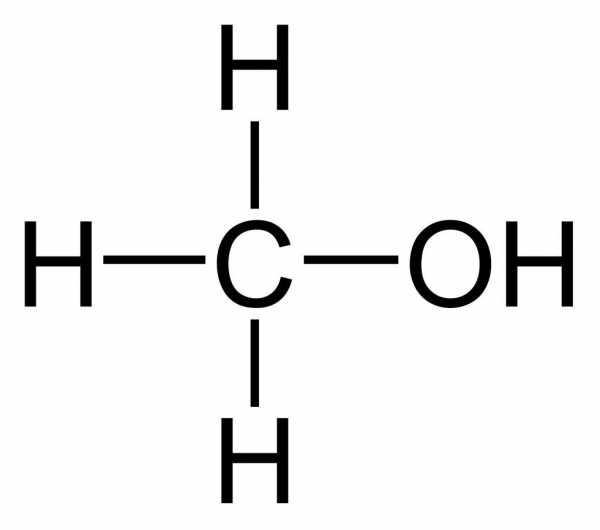
Если один из них заместить на гидроксильную группу –OH, получим формулу CH3OH. Это метанол. Валентный угол, построенный направлением связи C-O-H, составляет примерно 110⁰, поэтому молекулы одноатомных спиртов имеют угловую форму. Вследствие того, что электроотрицательность кислорода (3,5 эВ) больше, чем карбона (2,5 эВ), связь кислород – углерод очень поляризована, а гидроксогруппа играет роль заместителя, имеющего отрицательный индуктивный эффект. Таким образом, метанол – это спирт, у которого дипольный момент равен 1,69D.
Номенклатура
Рассмотрим три способа образования названия вещества, имеющего формулу CH3OH. Исторически оно образуется от названия углеводородного радикала, к которому присоединилась гидроксильная группа. Радикал CH3 — это метил, поэтому спирт CH3OH именуют метиловым. По Женевской номенклатуре, к названию соответствующего углеводорода – алкана – прибавляют суффикс –ол. Соединение будет называться метанолом. Это название наиболее распространено и используется достаточно часто. В рациональной номенклатуре рассматриваемое нами соединение называется карбинолом.
Физические свойства
Низшие спирты, содержащие до трех атомов карбона, куда входит и метанол, – это жидкости, смешивающиеся с водой в любых пропорциях. Карбинол имеет выраженный алкогольный запах, однако совершенно непригоден для употребления внутрь, так как является сильнейшим нейротоксичным соединением. Плотность его меньше единицы и составляет 0,791 D420. Температуры плавления и кипения равны -97,9 ⁰C и +94,5 ⁰C соответственно.
Получение метанола
Гидролиз соответствующих галогеноалкилов в присутствии гидроксидов активных металлов, например, щелочных или щелочноземельных, и при нагревании – это распространенный метод получения карбинола. В качестве исходных веществ берут хлор- или бромметан, результатом реакции будет замещение атома галогена функциональной группой –OH и получение метанола.
Еще один метод, ведущий к образованию первичных предельных спиртов – это восстановление альдегидов или карбоновых кислот. Для данной окислительно-восстановительной реакции применяют такие сильные восстановители, как натрийборгидрид или литийалюминийгидрид. Исходными соединениями являются муравьиная кислота или формальдегид. Один из современных методов получения карбинола – это его синтез из углерода, воды, водорода и монооксида углерода. Процесс проходит при температуре +250 °C, повышенном давлении и в присутствии окислов цинка и меди в качестве катализаторов. Новым, но экономически оправданным можно назвать метод получения спирта из микроскопических водорослей океанов и морей, биомасса которых действительно огромна. Растительный субстрат подвергают брожению, выделяющийся метан собирают и далее окисляют до метанола. Большими преимуществами производства биометанола считают отсутствие потребности в использовании запасов пресной воды, электроэнергии и чистоту технологии.

Металлорганический синтез
Если на органические вещества с карбонильной группой в составе молекул подействовать магнийорганическими соединениями, можно получить одноатомные спирты. Металлоорганические реагенты добывают при взаимодействии магниевых металлических стружек и бромсодержащих производных алканов в среде сухого диэтилового эфира. Из муравьиного альдегида данной реакцией можно получить не только метанол, применение которого ограничено, но и другие первичные предельные спирты.
Химическая характеристика
У карбинола нет ярко выраженных свойств кислот или оснований, к тому же водный раствор вещества не действует на индикаторы. Типичные реакции метанола – это взаимодействие с активными металлами и карбоновыми кислотами. В первом случае образуются алкоголяты металлов, во втором – сложные эфиры. Например, натрий вытесняет атомы водорода в функциональной гидроксильной группе спирта:
2CH3OH + 2Na = 2CH3ONa +H2.
Взаимодействие между метиловым спиртом и уксусной кислотой приводит к образованию метилацетата, или метилового эфира уксусной кислоты:
CH3COOH+CH3OH<—(H2SO4)—>CH3COOCH3+H2O.
Приведенная выше реакция именуется этерификацией и имеет важное практическое значение.

Окисление спиртов
Реакции метанола, приводящие к получению альдегидов, рассмотрим на примере его взаимодействия с оксидом меди. Если в раствор метанола опустить раскаленную проволоку из меди, покрытую оксидом, то ощущается особый неприятный запах образовавшегося формальдегида. А тусклая поверхность проволоки становится яркой и блестящей вследствие восстановления чистой меди.
Дегидратация
При нагревании и при наличии гигроскопических веществ от молекул спиртов происходит отщепление частиц воды. В продуктах можно обнаружить непредельные углеводороды ряда этилена. В условиях высокой концентрации воды и при пониженной температуре можно получить простые эфиры. Так, из метанола можно добыть диметиловый эфир.
Применение метилового спирта
Метиловый спирт используют в качестве ингибитора гидратов, образующихся в газовых трубопроводах, так как важные свойства метанола — это хорошая растворимость в воде и низкая температура замерзания. Основной объем метилового спирта используется в производстве фенолформальдегидных смол. Высокое октановое число, характерное для карбинола, позволяет применять его в качестве экологически чистого топлива для автомобилей. В лакокрасочной промышленности карбинол используют в качестве растворителя.
Влияние метанола на организм человека
Древесный спирт абсолютно непригоден для использования в качестве алкогольного напитка, так как является сильнейшим токсическим веществом. Попав в желудочно-кишечный тракт, он начинает окисляться до муравьиной кислоты и муравьиного альдегида. Продукты окисления поражают зрительные нервы и сетчатку глаза, содержащую рецепторы. Наступает слепота. Муравьиная кислота, обладающая высокой кумулятивной способностью, разносится кровью к печени и почкам, разрушая эти жизненно важные органы. В результате отравления метанолом имеет место летальный исход, так как способы очистки крови от метаболитов оказываются неэффективными.
В нашей статье мы ознакомились со свойствами, применением и способами получения метанола.
fb.ru
Где применяется метиловый спирт — NET-ALKO
Введение
Вы пришли вечером с работы, переоделись, затем, соблюдая свою привычку, сели в кресло перед телевизором и включили канал с новостями в эфире. Диктор сначала вещает что-то невразумительное, а потом выдает что-то вроде: «И, наконец, главная новость дня. В таком-то городе произошло массовое отравление метиловым спиртом. Погибло несколько десятков человек, еще столько же госпитализированы». Ваш слух моментально уловил название незнакомого вам вещества — «метиловый спирт». Большинство людей узнает о его существовании именно таким образом. Некоторые быстро забудут данное словосочетание, а некоторые захотят узнать о нем побольше. Вот для них в этой статье я и опишу все свойства метилового спирта.
Определение
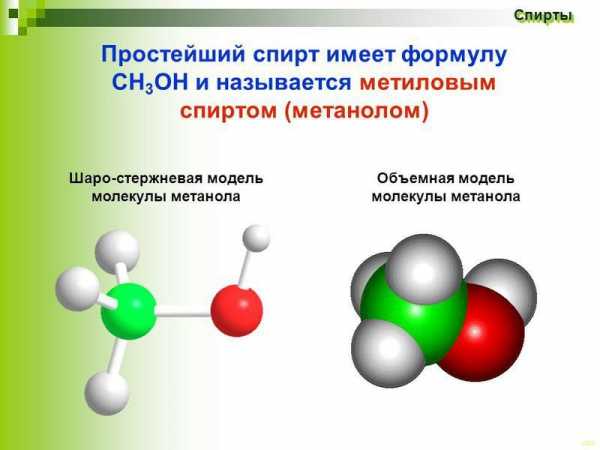
Метиловый спирт (формула СН3ОН) является простейшим одноатомным спиртом, первым представляющим гомологический ряд последних.
Название
В разных источниках его могут называть по-разному: и гидроксидом метила, и метанолом, и древесным спиртом, и карбинолом, и метилгидратом.
Получение метилового спирта
До 60-х годов ХХ века для синтезирования метилового спирта использовали только цинкохромовые, однако, позже этот опыт стали проводить на медьсодержащих катализаторах. Но сегодня его получают посредством каталитического синтеза из оксида углерода (II) и водорода при температуре 250С, давлении 7 мегапаскалей и определенных катализаторах (оксиде цинка и оксиде меди). До этого метиловый спирт получали сухой перегонкой дерева. Но сегодня этот способ является второстепенным. Для этой цели могут также использовать отходы нефтепереработки и коксующиеся угли.
Свойства
Метанол является бесцветной жидкостью, имеющей запах этилового спирта. Вода, этанол и эфир могут смешиваться с ним в любых отношениях. Сжимается и разогревается, когда его смешивают с водой. Также он имеет репутацию сильного растворителя и нередко может заменить этиловый спирт. Если в безводном метаноле растворить медный купорос, он становится голубовато-зеленого цвета. Из-за этого такой безводный купорос нельзя использовать, чтобы открыть следы воды в метиловом спирте. Метанол не может образовывать азеотропную смесь с водой, из-за этого смеси воды и метилового спирта могут быть разделены с помощью ректификационной перегонки. Метанол соединяется со многими солями, образуя сольваты. При реакции с едкой щелочью может давать алкоголяты.
 Метиловый спирт: отравление
Метиловый спирт: отравление
Метанол является сильнейшим ядом, его действию подвергаются нервная и сердечно-сосудистая системы. Отравление происходит из-за «летального синтеза» — метаболического окисления в организме, продуктом которого является очень ядовитый формальдегид. Тяжелое отравление наступает при попадании в организм 5-10 мл метилового спирта, а если это 30 или больше грамм — неизбежны слепота и/или летальный исход. Симптомы легкого отравления — это головная боль, общая слабость, недомогание, озноб, тошнота и рвота. Из-за этого опасными для жизни являются продукты даже с малейшей концентрацией метанола. Антидот при отравлении этим веществом — это этиловый спирт. Он вводится внутривенным или пероральным путями. Однако самим это делать не следует — при неправильных диагнозе и дозировке положение только ухудшится. Так что при подозрении на отравление метиловым спиртом необходимо срочно вызывать врача.
Применение
В газовой промышленности борьба с образованием гидратов не обходится без метилового спирта. С помощью него производят формальдегид, формалин, уксусную кислоту и целый ряд эфиров. Метанол используют при изготовлении растворителей для лаков. Он также может служить добавкой к жидким топливам для двигателей внутреннего сгорания и быть заправкой к мотоциклам и автомобилям. Из метилового спирта получают биодизель. Также в парфюмерии он — денатурирующая добавка к этанолу. Топливные элементы работают только благодаря окислению метанола в оксид углерода (IV) на катализаторе.
Заключение
Теперь вы знаете о метиловом спирте всё. И, как видите, несмотря на свою ядовитость, он может быть и очень полезным человеку, только при осторожном обращении с ним.
www.syl.ru
Какой спирт нельзя пить этиловый или метиловый?
Незнающие люди могут подумать, что употреблять можно любой спирт. Но на самом деле это неправильно. Ведь не все виды спирта это алкоголь, среди спиртов очень много ядов. Не стоит принимать метиловый спирт, так как это отрава.
 Какой спирт нельзя пить этиловый или метиловый?
Какой спирт нельзя пить этиловый или метиловый?Из чего делают метиловый спирт, какой он на вкус, чем пахнет?
По вкусу и запаху отличить этиловый и метиловый спирт сложно. Они практически неотличимы и вы даже не догадаетесь, что пьете подделку. Вкус и запах такой, как у этилового спирта. Изготавливали спирт при помощи синтеза из водорода, но сейчас этот способ считается кустарным и не применяется. Наиболее дешевым можно считать производство из отходов нефтепродуктов.
 Из чего делают метиловый спирт, какой он на вкус, чем пахнет?
Из чего делают метиловый спирт, какой он на вкус, чем пахнет?Для чего нужен метиловый спирт, где применяют?
В основном метанол применяют в химической промышленности. Это вспомогательное вещество для получения многих растворителей.
Сфера применения метилового спирта:
- Для изготовления растворителей
- В лакокрасочной промышленности
- При производстве биодизеля из масел
- Для борьбы с гидратами в газовой промышленности
 Для чего нужен метиловый спирт, где применяют?
Для чего нужен метиловый спирт, где применяют?Как метиловый спирт отличить от этилового?
Дело в том, что 30-100 мл метилового спирта может привести к судорогам и даже смертельному исходу. Соответственно ошибиться нельзя, так как это чревато плачевными последствиями. На вкус и запах спирты одинаковые. Не специалист по вкусу не отличит эти жидкости.
Способы проверить спирт:
- Поджигание. Налейте в ложку немного жидкости и подожгите. Этиловый спирт будет гореть синим пламенем, а метиловый зеленым.
- Испытание картофелем. Очистите картофель и нарежьте на кусочки. Один ломтик погрузите в этанол, а второй в метанол. Если ломтик стал розовым, перед вами отрава, то есть метиловый спирт. В алкоголе картофель практически не меняет цвет.
- Медная проволока. Раскалите до черна кусочек медной проволоки, и окуните в жидкость. Если вы почувствуете запах уксуса, то спирт этиловый и его можно пить. Если запах будет неприятным, то спирт метиловый.
 Как метиловый спирт отличить от этилового?
Как метиловый спирт отличить от этилового?Формула этилового и метилового спирта
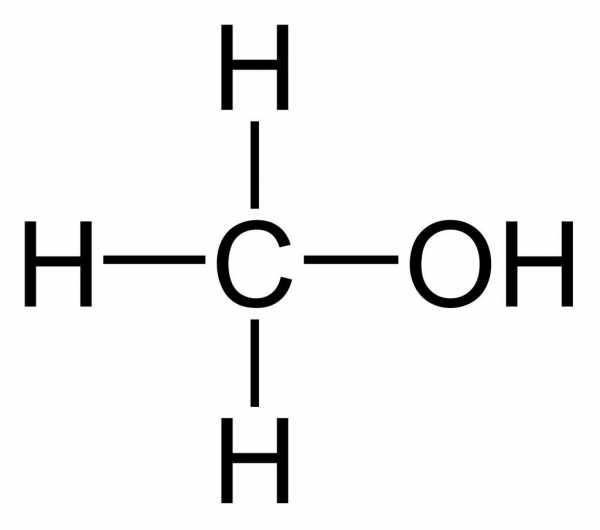
Ниже приведены формулы спиртов:
СН3ОН – метиловый спирт
С2Н5ОН – этиловый спирт
 Формула этилового и метилового спирта
Формула этилового и метилового спиртаКак проверить спирт этиловый или метиловый в алкоголе – водке или самогоне, в домашних условиях?
Существует несколько способов определить подделку:
- Пищевая сода. Всыпьте в жидкость немного пищевой соды и наблюдайте за реакцией. Если имеются примеси метилового спирта, сода растворится полностью. Если продукт хорошего качества, то образуется желтый осадок и спирт пить можно.
- Марганцовка. Всыпьте в емкость с жидкостью марганцовку. Если на поверхности появятся пузыри, то спирт метиловый. Если нет, то этиловый.
- Кипячение. Это можно узнать при помощи термометра, температура кипения этанола 78 °С, а метанола 64 °С.
Каким цветом горит метиловый и этиловый спирт?
Этот метод тоже применяется для идентификации спирта. Этанол горит синим пламенем, а вредный метанол зеленым.
 Каким цветом горит метиловый и этиловый спирт?
Каким цветом горит метиловый и этиловый спирт?Какую окраску приобретает индикатор метиловый оранжевый?
Этот индикатор реагирует на изменение кислотности. Самое интересное, что метиловый оранжевый изготовлен на основе метилового спирта. Поэтому при введении индикатора в метанол ничего не поменяется. Раствор будет оранжевым. Этанол имеет примерно нейтральную среду, поэтому и окраска существенно не изменится. Раствор будет оранжевым. Таким образом, при помощи индикатора отличить эти спирты нельзя.
 Какую окраску приобретает индикатор метиловый оранжевый?
Какую окраску приобретает индикатор метиловый оранжевый?Метиловый спирт, метанол — влияние на организм человека: первые признаки и симптомы отравления, смертельная доза для человека
Метиловый спирт является очень сильным ядом, он отличается нервно паралитическим действием. Примерно 30-100 мл метанола вызывает сильное отравление и судороги.
Симптомы отравления:
- Головокружение
- Сонливость
- Слюноотделение
- Нарушение координации движений
Чтобы потерять зрение достаточно выпить 10 мл, а чтобы умереть 30-100 мл.
 Метиловый спирт, метанол — влияние на организм человека: первые признаки и симптомы отравления, смертельная доза для человека
Метиловый спирт, метанол — влияние на организм человека: первые признаки и симптомы отравления, смертельная доза для человекаЧто делать, если выпил метиловый спирт, через сколько проявляется отравление?
Если вы сомневаетесь в качестве алкоголя, то не пейте его. Но если все же вы не удержались, понаблюдайте за своим состоянием.
Проявление отравления:
- Мушки перед глазами
- Скачки давления
- Рвота
- Тошнота
- Обильные слюни
Вообще, метанол накапливается в организме, поэтому симптомы отравления могут появиться не сразу. В среднем действие метанола проявляется от 30 минут до 3 суток. И самое печальное, что на третьи сутки становится не лучше, а хуже. Можно заметить потерю зрения и редкое мочеиспускание. Это говорит, что почки плохо работают.
 Что делать, если выпил метиловый спирт, через сколько проявляется отравление?
Что делать, если выпил метиловый спирт, через сколько проявляется отравление?Первая неотложная помощь при отравлении метиловым спиртом, метанолом
Неотложная помощь:- Положите пациента на живот, если он без сознания. Это поможет избежать удушья
- Дайте большое количество раствора пищевой соды
- Вызовите у больного рвоту
- Дайте больному слабительное
- Вызовите скорую помощь
Метиловый спирт: противоядие
Самое интересное, что противоядием является чистый спирт или хорошая водка. Необходимо каждые 3 часа по 50 г водки.
 Метиловый спирт: противоядие
Метиловый спирт: противоядиеОтравился метиловым спиртом, метанолом, последствия – смерть, слепота
На самом деле последствия отравления очень печальные. Это может привести к смерти или слепоте.
Последствия:
- Потеря зрения
- Отказ почек
- Одышка
- Судороги
- Эпилепсия
- Цирроз
 Отравился метиловым спиртом, метанолом, последствия – смерть, слепота
Отравился метиловым спиртом, метанолом, последствия – смерть, слепотаМетиловый спирт, метанол: можно ли отравиться парами?
Варианты отравления при вдыхании паров:
- Отравление может произойти из-за попадания вещества на кожу при протирании лобового стекла. Чтобы этого не произошло, нужно заливать ее в автомобиль в хорошо проветриваемом помещении, используя перчатки.
- Отравиться метанолом можно на химическом производстве. Также метанол входит в состав некоторых красок, лаков и растворителей. Отравление может произойти в случае не соблюдения правил безопасности.
- А при покраске или уходе за автомобилем (с применением химических средств), нужно непременно соблюдать правила безопасности.
 Метиловый спирт, метанол: можно ли отравиться парами?
Метиловый спирт, метанол: можно ли отравиться парами?Метиловый спирт по вкусу и запаху мало чем отличается от этилового, поэтому будьте внимательны и не пейте сомнительные алкогольные напитки.
heaclub.ru
Описание продукта и его использование в жизнедеятельности человека

Сегодня продукт получают путем каталитического синтеза при 2500С из водорода и ОН, используя давление 7 мПа и определенных катализаторах (оксид цинка, меди). До начала второй половины ХХ столетия метиловый спирт получали путем сухой перегонки древесины.
На сегодняшний день такой «древесный» способ считается второстепенным и практически не используется. А с целью производства более дешевого продукта используют нефтеперегонные отходы.
Внешние характеристики метанола:
- жидкость, не имеющая цвета;
- запах схож с этиловым спиртом, но не так ярко выраженный.
Эфиры, этанол, а также вода могут легко смешиваться с ним в любых пропорциях. Метиловый спирт имеет свойство разогреваться и сжиматься при соединении с водой. При смешивании медного купороса и чистого метанола образуется жидкость с голубоватым оттенком. Отличается низкой температурой закипания – 64,50С. Метанол легко воспламеняется, а огонь имеет бледно-голубоватый с оттенком зеленого цвет.
У метанола есть несколько способов использования. В химической отрасли его применяют для производства пластмассы. Это одна из составляющих антифризов и растворителей.
Он используется и в качестве топлива. Особенно часто его применяют в спортивных автомобилях. Некоторые крупные автогиганты выпустили даже экспериментальные автомодели, которые работали на этом виде топлива.
В газовой промышленности метанол применяют в борьбе с образованием гидратов.
Метиловый спирт – это яд, действие которого распространяется после внутреннего приема и негативно влияет на нервную и сосудистую системы организма.
Метанол хоть и является одним из видов алкоголя, но потреблять его внутрь строго воспрещается. Даже в небольшом количестве он может негативно повлиять на человека. Это опасное и ядовитое вещество.
Отравление метиловым спиртом
После приема внутрь метанол даже в минимальной дозе приводит к отравлению человека. Если 5–10 мл этого спирта вызывает слепоту, то доза в 30 грамм становится смертельной. Но для каждого человека количество пагубной дозы разнится, поэтому точно сказать о ней невозможно. Длительность действия на организм длится от 6 часов до 10 суток, что также зависит от особенностей человека.
После приема вещество пагубно действует на нервную и сосудистую систему. Человек умирает в результате нарушения работы дыхательных органов, что приводит к отечности легких и головного мозга.
Отравления метиловым спиртом классифицируют на такие виды:
- Быстропротекающее отравление возникает при одновременном приеме достаточно большой дозы древесного спирта. У человека очень быстро наблюдается глухота, потеря сознания, коллапс. Летальный исход может произойти уже через 2 часа.
- Замедленный вид интоксикации может иметь легкую, среднюю и более тяжелую форму отравления.
К симптоматике легкой степени относят такие признаки:
- острая боль в голове;
- общая слабость, вялость или недомогание;
- тошнота и рвота;
- озноб.
Но реакция может быть разной. Она очень схожа с признаками отравления этилом. И во многих случаях их путают. Человек на первых этапах отравления может и не догадываться о том, что употребил яд, а свое состояние воспринимает как реакцию на опьянение. Но при отравлении метиловым спитом во многих случаях тревожные симптомы нарастают.
Метил разрушает сосуды, нервные клетки, приводит к потере остроты зрения и слепоты. Человеку после отравления метилом необходима срочная квалифицированная помощь медицинских работников.
При этом опасность для человека составляет не только чистый метил, но и применение смесей, в которых даже в минимальных дозах содержится этот компонент.
Отравление организма человека может происходить не только в результате попадания его в пищеварительный тракт, но и при вдыхании паров метанола, которые проникают через легкие. Метил имеет способность впитываться через кожные покровы.
После попадания внутрь он всасывается тканями, распределяясь по всему организму. Наибольшее его количество концентрируется в почках, желудке, кишечнике, а наименьшее его – в мышцах и жировой ткани, мозге.
У человека, который отравился метанолом, концентрация вещества в крови находится в пределах от 74 до 100 мг/куб. дм. Если отравление метанолом привело к смертельному исходу, то количество метанола в сыворотке крови составляет более 100 мг/куб.дм. Но такие показатели не являются догмой, так как смерть наступала и при других значительно меньших показателях, что, возможно, связано с прошествием времени, с момента потребления токсического вещества.
Потребление яда может быть целенаправленным или непредумышленным. Сегодня все чаще можно услышать, что люди отравились после потребления водки. После исследований продукта выяснилось, что это фальсификат, и в его состав добавлен метиловый спирт.
При первых проявлениях отравления метилом, должна быть быстрая реакция, направленная на очистку желудка от остатков не всосавшегося спирта путем искусственного вызывания рвоты.
Отравившемуся нужны кислородные ингаляции. В домашних условиях, при отсутствии кислородной маски, его нужно вывести на свежий воздух. Прием активированного угля в этом случае оказывается не эффективный. Также очень важно быстро обратиться в медицинское учреждение для промывания и назначения лечения.
Терапия таких больных проводится двумя антидотными средствами:
- этиловый спирт (не применяйте в домашних условиях!) действует как нейтрализатор метанола, не позволяя ему метаболизироваться в печени;
- метилпиразол – алкогольдегидрогиназ.
Этиловый спирт, разведенный с глюкозой, при отравлении метиловым спиртом назначают внутривенно в более тяжелых стадиях интоксикации. При этом придерживаются определенной дозировки, которая назначается в соответствии с состоянием пациента. Первая доза вводится внутрь через зонд или дается выпить, если пострадавший в сознании.
Как правильно различать?
К большому сожалению, определить, что именно перед вами: этиловый или метиловый спирт практически невозможно. Особенно тяжело определить метил, если он входит в состав другого алкогольного продукта.
В домашних условиях есть два способа выявить древесный спирт.
Для этого нужно приготовить:
- емкость металлическую;
- градусник;
- проволоку медную;
- емкость прозрачную.
В металлическую емкость наливается жидкость и ставится на газовую горелку. Метиловый спирт должен закипать при температуре 640С, а реакция этанола наступает при 780С. Это будет первый способ определить, что перед нами.
Второй способ – при помощи медной проволоки. Ее необходимо раскалить добела, после чего окунуть в исследуемую жидкость. Далее, очень осторожно принюхиваемся к парам. Этанол имеет более приятный аромат, чем-то напоминающий яблоки. Если перед вами метанол, то испарения будут иметь раздражающий запах.
Но такой вид определения может быть применен только к неразбавленным спиртам.
Для выявления наличия метила проводят такое испытание – поджигание. Часть испытуемого материала необходимо налить в посуду и поджечь. Если перед вами этиловый спирт, то пламя будет синего цвета. Если в составе есть метиловый спирт, то он даст зеленоватый оттенок.
Для определения состава алкогольной продукции применяют сырой картофель. Для этого эксперимента в посудину с исследуемой жидкостью вкладывают кусочек этого корнеплода. Реакция на метанол по прошествии нескольких часов даст выраженный розовый оттенок. Если существенных изменений в цвете нет, то ваш продукт не содержит примесей метилового спирта.
Поэтому определить, нет ли в алкоголе метила практически невозможно. Но существует ряд правил, которые минимизируют возможность вхождения в состав этого ядовитого вещества. Как же не попасть на фальсификат и не отравиться метиловым спиртом.
Обращайте внимание на происхождение продукта. Покупайте только сертифицированный товар в точках, которые проверены и не занимаются продажей фальсификатов.
Лучше закупать продукцию в специализированных алкомаркетах, а не в небольших ларечках. Также обращайте внимание на стоимость. Если она намного ниже других, то от покупки такого продукта лучше отказаться.
alcogolizm.com
Отравления
Острые и хрон, отравления М. с. возникают при превышении предельно допустимой концентрации его паров в воздухе, а также при попадании М. с. на незащищённую кожу или при сильном загрязнении спецодежды и обуви. Особенно опасен прием М. с. внутрь вместо этилового спирта: 5—10 мл М. с. могут вызвать тяжелое отравление, а 30 мл — привести к смертельному исходу.
При хрон, отравлении М. с. нарушаются окислительно-восстановительные процессы в головном мозге, появляются изменения сосудов головного мозга и особенно сосудов органа зрения, приводящие к изменениям и частичной гибели фоторецепторных, ганглиозных клеток сетчатки (см.), разрастанию глии, дегенеративным изменениям нейронов в центральной части зрительного анализатора (см.). При отравлении М. с. развиваются дистрофические изменения в печеночных клетках, что ведет к стойкой функциональной неполноценности печени, не исчезающей после клин, выздоровления.
Хрон, отравление малыми концентрациями М. с. характеризуется головокружением, головной болью, бессонницей, повышенной утомляемостью, жел.-киш. расстройствами, ухудшением зрения, прежде всего цветового. При хрон, воздействии паров М. с. в концентрации 50 мг/м3 и выше у работающих на производстве, связанном с получением или использованием М. с., выявлены функциональные изменения органа зрения.
Острое отравление М. с. характеризуется состоянием легкого опьянения, тошнотой, рвотой, сильной головной болью, резким ухудшением зрения вплоть до слепоты, при утяжелении состояния появляются цианоз, затрудненное дыхание, расширение зрачков, судороги и смерть от остановки дыхания. Диагноз подтверждается обнаружением в моче муравьиной к-ты, а также анализом рвотных масс и недопитой жидкости.
Первая помощь
При попадании М. с. в глаза необходимо промыть их сильной струей воды, при загрязнении кожи — быстро смыть с нее М. с. водой и сменить одежду.
При приеме М. с. внутрь необходимо немедленно начать промывание желудка и продолжать его в течение первых 2 часов, необходимо также начать борьбу с ацидозом путем введения внутрь 2—4 л и внутривенно 1 л 5% р-ра гидрокарбоната натрия (питьевой соды). Внутривенно вводят 5% р-р этилового спирта, к-рый, конкурируя с М. с. за окислительные ферменты, задерживает образование в организме токсичных метаболитов М. с. По показаниям — заменное переливание крови, гемосорбция (см. Гемосорбция), вдыхание мед. кислорода, сердечные средства.
Аналогичные меры принимают при отравлении суррогатами винного спирта, содержащими примесь М. с. (см. Денатурированный спирт).
Меры предупреждения
Применение М. с. допускается лишь в тех производственных процессах, где он не может быть заменен менее токсичным веществом. В СССР запрещено изготовление политур, мастик и нитролаков на М. с. Предприятия обязаны согласовывать введение М. с. в производство с органами сан. надзора. Особенно строго регламентируются маркировка тары для М. с., правила его хранения и расхода, чтобы исключить случайный прием М. с. внутрь. Работающие с М. с. проходят специальный инструктаж, обеспечиваются защитными перчатками, резиновыми фартуками и противогазами марки «А». Рабочую одежду стирают каждые 10 дней.
Метиловый спирт в судебно-медицинском отношении
Отравления М. с. нередко бывают групповыми; обычно пострадавшие недостаточно информированы о ядовитости М. с. или пренебрегают ею. Смертельная доза при приеме внутрь 30—100 мл.
Цатологоанатомические изменения характерны для острой смерти и свидетельствуют о поражении сосудистой системы (выраженное полнокровие со стазами и мелкими множественными кровоизлияниями в головной мозг и другие внутренние органы, кровоизлияния в серозные и слизистые оболочки, темная «дегтеобразная» кровь в крупных сосудах и синусах твердой мозговой оболочки и др.). Наблюдаются симметричные очаги размягчения в головном мозге, в области внутренней капсулы, полосатого тела, иногда мозжечка. Распределение М. с. во внутренних органах зависит от относительного содержания в них воды, поэтому для хим. исследования берут кровь, мочу, цереброспинальную жидкость, почку, печень, мозг и желудок с содержимым. М. с. быстро всасывается и медленно окисляется, в крови максимальная его концентрация создается через 4—16 час.; длительнее всего М. с. сохраняется в цереброспинальной жидкости — до 12 дней.
М. с. частично выделяется слизистой оболочкой желудка, поэтому в промывных водах и рвотных массах его можно обнаружить в течение 2 сут. Муравьиная к-та — ядовитый метаболит М. с. — содержится в крови, моче, печени, почках и мозге. С мочой она выделяется в течение 5—6 дней.
Для суд.-хим. обнаружения М. с. используют метод газожидкостной хроматографии (см.).
Библиография: Бережной Р. В. Судебно-медицинская экспертиза отравлений техническими жидкостями, с.26, М., 1977; Вредные вещества в промышленности, под ред. Н. В. Лазарева и Э. Н. Левиной, т. 1, с. 363, Л., 1976; Гадаскина И. Д. и Филов В. А. Превращения и определение промышленных органических ядов в организме, с. 232, Л., 1971; Егоров Ю. Л. и др. Состояние органа зрения работающих в производстве синтетических жирных кислот и спиртов и вопросы гигиенического нормирования содержания спиртов в воздухе, Гиг. труда и проф. заболев., № 11, с. 33, 1966; Несмеянов А. Н.иНесмеяновН.А. Начала органической химии, кн. 1, М., 1974; Робертс Дж. иКасериоМ. Основы органической хидии, пер. с англ., т. 1, с. 405, М.,1978; РозенбаумН.Д. Гигиена труда при работе с органическими растворителями, Свердловск, 1946; М о с-s с h 1 i n S. Klinik und Therapie der Vergiftungen, Lpz., 1964.
В. И. Розенгарт; Ю. Л. Егоров, P. В. Бережной (суд.).
бмэ.орг
Описание продукта и его использование в жизнедеятельности человека

Сегодня продукт получают путем каталитического синтеза при 2500С из водорода и ОН, используя давление 7 мПа и определенных катализаторах (оксид цинка, меди). До начала второй половины ХХ столетия метиловый спирт получали путем сухой перегонки древесины.
На сегодняшний день такой «древесный» способ считается второстепенным и практически не используется. А с целью производства более дешевого продукта используют нефтеперегонные отходы.
- жидкость, не имеющая цвета;
- запах схож с этиловым спиртом, но не так ярко выраженный.
Эфиры, этанол, а также вода могут легко смешиваться с ним в любых пропорциях. Метиловый спирт имеет свойство разогреваться и сжиматься при соединении с водой. При смешивании медного купороса и чистого метанола образуется жидкость с голубоватым оттенком. Отличается низкой температурой закипания – 64,50С. Метанол легко воспламеняется, а огонь имеет бледно-голубоватый с оттенком зеленого цвет.
У метанола есть несколько способов использования. В химической отрасли его применяют для производства пластмассы. Это одна из составляющих антифризов и растворителей.
Он используется и в качестве топлива. Особенно часто его применяют в спортивных автомобилях. Некоторые крупные автогиганты выпустили даже экспериментальные автомодели, которые работали на этом виде топлива.
В газовой промышленности метанол применяют в борьбе с образованием гидратов.
Метиловый спирт – это яд, действие которого распространяется после внутреннего приема и негативно влияет на нервную и сосудистую системы организма.
Метанол хоть и является одним из видов алкоголя, но потреблять его внутрь строго воспрещается. Даже в небольшом количестве он может негативно повлиять на человека. Это опасное и ядовитое вещество.
Отравление метиловым спиртом
После приема внутрь метанол даже в минимальной дозе приводит к отравлению человека. Если 5–10 мл этого спирта вызывает слепоту, то доза в 30 грамм становится смертельной. Но для каждого человека количество пагубной дозы разнится, поэтому точно сказать о ней невозможно. Длительность действия на организм длится от 6 часов до 10 суток, что также зависит от особенностей человека.
После приема вещество пагубно действует на нервную и сосудистую систему. Человек умирает в результате нарушения работы дыхательных органов, что приводит к отечности легких и головного мозга.
- Быстропротекающее отравление возникает при одновременном приеме достаточно большой дозы древесного спирта. У человека очень быстро наблюдается глухота, потеря сознания, коллапс. Летальный исход может произойти уже через 2 часа.
- Замедленный вид интоксикации может иметь легкую, среднюю и более тяжелую форму отравления.
- острая боль в голове;
- общая слабость, вялость или недомогание;
- тошнота и рвота;
- озноб.
Но реакция может быть разной. Она очень схожа с признаками отравления этилом. И во многих случаях их путают. Человек на первых этапах отравления может и не догадываться о том, что употребил яд, а свое состояние воспринимает как реакцию на опьянение. Но при отравлении метиловым спитом во многих случаях тревожные симптомы нарастают.
Метил разрушает сосуды, нервные клетки, приводит к потере остроты зрения и слепоты. Человеку после отравления метилом необходима срочная квалифицированная помощь медицинских работников.
При этом опасность для человека составляет не только чистый метил, но и применение смесей, в которых даже в минимальных дозах содержится этот компонент.
Отравление организма человека может происходить не только в результате попадания его в пищеварительный тракт, но и при вдыхании паров метанола, которые проникают через легкие. Метил имеет способность впитываться через кожные покровы.
После попадания внутрь он всасывается тканями, распределяясь по всему организму. Наибольшее его количество концентрируется в почках, желудке, кишечнике, а наименьшее его – в мышцах и жировой ткани, мозге.
У человека, который отравился метанолом, концентрация вещества в крови находится в пределах от 74 до 100 мг/куб. дм. Если отравление метанолом привело к смертельному исходу, то количество метанола в сыворотке крови составляет более 100 мг/куб.дм. Но такие показатели не являются догмой, так как смерть наступала и при других значительно меньших показателях, что, возможно, связано с прошествием времени, с момента потребления токсического вещества.
Потребление яда может быть целенаправленным или непредумышленным. Сегодня все чаще можно услышать, что люди отравились после потребления водки. После исследований продукта выяснилось, что это фальсификат, и в его состав добавлен метиловый спирт.
При первых проявлениях отравления метилом, должна быть быстрая реакция, направленная на очистку желудка от остатков не всосавшегося спирта путем искусственного вызывания рвоты.
Отравившемуся нужны кислородные ингаляции. В домашних условиях, при отсутствии кислородной маски, его нужно вывести на свежий воздух. Прием активированного угля в этом случае оказывается не эффективный. Также очень важно быстро обратиться в медицинское учреждение для промывания и назначения лечения.
- этиловый спирт (не применяйте в домашних условиях!) действует как нейтрализатор метанола, не позволяя ему метаболизироваться в печени;
- метилпиразол – алкогольдегидрогиназ.
Этиловый спирт, разведенный с глюкозой, при отравлении метиловым спиртом назначают внутривенно в более тяжелых стадиях интоксикации. При этом придерживаются определенной дозировки, которая назначается в соответствии с состоянием пациента. Первая доза вводится внутрь через зонд или дается выпить, если пострадавший в сознании.
Как правильно различать?
К большому сожалению, определить, что именно перед вами: этиловый или метиловый спирт практически невозможно. Особенно тяжело определить метил, если он входит в состав другого алкогольного продукта.
В домашних условиях есть два способа выявить древесный спирт.
- емкость металлическую;
- градусник;
- проволоку медную;
- емкость прозрачную.
В металлическую емкость наливается жидкость и ставится на газовую горелку. Метиловый спирт должен закипать при температуре 640С, а реакция этанола наступает при 780С. Это будет первый способ определить, что перед нами.
Второй способ – при помощи медной проволоки. Ее необходимо раскалить добела, после чего окунуть в исследуемую жидкость. Далее, очень осторожно принюхиваемся к парам. Этанол имеет более приятный аромат, чем-то напоминающий яблоки. Если перед вами метанол, то испарения будут иметь раздражающий запах.
Но такой вид определения может быть применен только к неразбавленным спиртам.
Для выявления наличия метила проводят такое испытание – поджигание. Часть испытуемого материала необходимо налить в посуду и поджечь. Если перед вами этиловый спирт, то пламя будет синего цвета. Если в составе есть метиловый спирт, то он даст зеленоватый оттенок.
Для определения состава алкогольной продукции применяют сырой картофель. Для этого эксперимента в посудину с исследуемой жидкостью вкладывают кусочек этого корнеплода. Реакция на метанол по прошествии нескольких часов даст выраженный розовый оттенок. Если существенных изменений в цвете нет, то ваш продукт не содержит примесей метилового спирта.
Поэтому определить, нет ли в алкоголе метила практически невозможно. Но существует ряд правил, которые минимизируют возможность вхождения в состав этого ядовитого вещества. Как же не попасть на фальсификат и не отравиться метиловым спиртом.
Обращайте внимание на происхождение продукта. Покупайте только сертифицированный товар в точках, которые проверены и не занимаются продажей фальсификатов.
Лучше закупать продукцию в специализированных алкомаркетах, а не в небольших ларечках. Также обращайте внимание на стоимость. Если она намного ниже других, то от покупки такого продукта лучше отказаться.
Внимание, только СЕГОДНЯ!alcoruguru.ru
Метиловый спирт представляет собой легкоподвижную бесцветную жидкость, которая по запаху и вкусу напоминает этиловый спирт. Он способен растворяться во многих органических растворителях: в бензоле, сложных эфирах, а также в воде. Метиловый спирт кипит при температуре 64оС. Для различных смесей, в состав которых он входит, это значение может несколько отличаться.
Впервые метиловый спирт получили Ж.Дюма и Э.Пелиго с помощью продуктов переработки сухой древесины. Это произошло в конце 19 века. Уже в 1923 году его начали синтезировать в промышленных масштабах.
С химической точки зрения метиловый спирт относится к одноатомным спиртам, который обладает свойствами слабой кислоты и основания. Он способен реагировать с водяными парами в присутствии катализатора (реакция имеет место в установках небольшой мощности). В результате такого взаимодействия получается смесь водорода и двуокиси углерода. Если очистить эту смесь от углекислого газа, можно получить 98% водород. При взаимодействии с активными металлами (натрий, калий и другие) получаются метилаты, а с кислотами — сложные эфиры.
Метиловый спирт — сильный яд для организма. Даже небольшой дозы (около 5-10 мл) достаточно, чтобы навсегда потерять зрение. При легком отравлении наблюдается сильная головная боль и тошнота. Человек очень быстро утомляется и становится раздражительным. При отравлениях средней тяжести больного беспокоят частые головокружения, рвота и головные боли. Метиловый спирт поражает центральную нервную систему и через 2-6 дней вызывает частичную или полную потерю зрения. При тяжелых отравлениях наблюдаются все вышеперечисленные симптомы, которые довольно быстро перерастают в кому. Артериальное давление понижается, зрачки расширяются, а дыхание становится поверхностным. После тяжелого отравления метиловым спиртом выжить удается трем людям из четырех. Они остаются инвалидами на всю жизнь.
Метиловый спирт применяют в промышленности для изготовления множества органических веществ: уксусной кислоты, метилхлоридов, метиламинов, а также некоторых лекарств. Этот спирт обладает высоким октановым числом, что позволяет использовать его как добавку к бензину в целях экономии сырья. Активно разрабатываются технологии получения из него других спиртов: в частности, этилового.
www.kakprosto.ru
net-alko.site
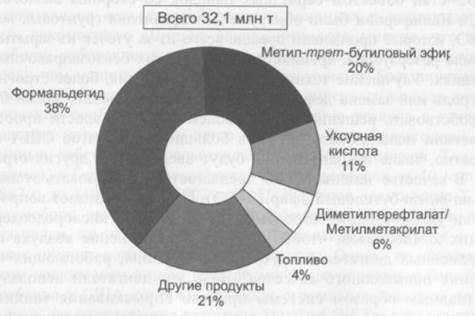
Метанол, один из основных продуктов многотоннажной химии, широко используется для получения множества ценных химических вещест
Группа компаний «ЭНЕРГОСИНТОП» 125412 Москва, ул.Ижорская, д.13/19, корп.1-Б, офис 205 |
МОДУЛЬНЫЕ ЭНЕРГОНЕЗАВИСИМЫЕ УСТАНОВКИ ДЛЯ ПЕРЕРАБОТКИ УГЛЕВОДОРОДНЫХ ГАЗОВ В МЕТАНОЛ, ВЫСОКО- ОКТАНОВЫЙ БЕНЗИН, ДИМЕТИЛОВЫЙ ЭФИР И ВОДОРОД |
|
|
тел.4841629 [email protected] |
МЕТАНОЛ
Метанол (общепринятые названия-метиловый спирт, древесный спирт).
Химическая формула – CH3OH. Один из основных продуктов многотоннажной
химии, широко используется для получения множества ценных химических
веществ: формальдегида, сложных эфиров, аминов, растворителей, уксусной
кислоты. Мировое производство метанола превышает 20 млн т в год, и спрос на него постоянно растет, что связано с наметившейся тенденцией использовать метанол в новых областях, например для получения высокооктановых бензинов, топлива для электростанций, как сырья для синтеза белка и т.д.С этапами изучения химии метанола связаны имена величайших химиков. Впервые метанол был обнаружен еще в середине XVII века Робертом Бойлем при изучении продуктов перегонки дерева, однако в чистом виде метиловый спирт, или древесный, получаемый этим способом, был выделен только через 200 лет: тогда впервые удалось очистить его от примесей сопутствующих веществ, прежде всего уксусной кислоты и ацетона. В 1857 году Марселен Бертло получил метанол омылением хлористого метила. Процесс сухой перегонки древесины долгое время оставался, пожалуй, единственным способом производства метанола. Сейчас он полностью вытеснен каталитическим синтезом из оксида углерода и водорода. Получение метанола из синтез-газа впервые было осуществлено в Германии в 1923 году фирмой BASF. Процесс проводился под давлением 100-300атм на оксидных цинк-хромовых катализаторах (ZnO-Cr2O3) в интервале температур 320-400С, производительность первой промышленной установки доходила до 20 т/сут. Интересно, что в 1927 году в США был реализован промышленный синтез метанола, основанный не только на монооксиде, но и на диоксиде углерода. В настоящее время в результате развития и усовершенствования процесса получения метанола из синтез-газа используются реакторы большой мощности с производительностью до 2000 т метанола в сутки. Разработаны более активные катализаторы на основе оксидов цинка и меди, которые позволили смягчить условия синтеза — снизить давление до 50-100 атм, а температуру — до 250C. Суммарная реакция образования метанола: CO + 2h3=Ch4OH
СИНТЕЗЫ НА ОСНОВЕ МЕТАНОЛА
Значительный рост темпов производства метанола связан, с одной стороны, с все расширяющимися сферами его применения и, с другой — с возрастающим дефицитом природного сырья (нефть, газ). Ниже показаны некоторые направления использования метанола.
Более 40% производимого метанола идет на получение формальдегида. Производство формальдегида в крупных масштабах обусловлено использованием его для получения ценных веществ, прежде всего формальдегидных смол, находящих широкое применение в промышленности полимеров: фенолформальдегидных, мочевиноформальдегидных и др. На это расходуется более 60% производимого формальдегида. Следует упомянуть использование формальдегида в качестве промежуточного вещества для получения изопрена, гексаметилентетрамина (уротропина), пентаэритрита и других ценных продуктов.
Уксусная кислота — важнейший химический продукт, который широко используется в промышленности для получения сложных эфиров, мономеров (винилацетат), в пищевой промышленности и т.д. Мировое производство ее достигает 5 млн т в год. Получение уксусной кислоты до недавнего времени базировалось на нефтехимическом сырье.
Из метанола также производится большое число органических растворителей и антифризов, автомобильных стеклоомывателей, красителей и проч. В настоящее время разворачивается промышленное производство новых типов элементов электропитания для мобильных компьютеров, телефонов и других электронных устройств на основе топливных элементов, в которых в качестве топлива служит метанол.
МЕТАНОЛ КАК АЛЬТЕРНАТИВНЫЙ ЭНЕРГОНОСИТЕЛЬ
Важнейшей проблемой в настоящее время является поиск альтернативных энергоносителей. Это связано не только с наступающим дефицитом нефтяного сырья, но и с проблемами экологии. Транспорт потребляет около 40% нефти, добываемой в мире. Использование углеводородного топлива в двигателях внутреннего сгорания сопровождается выбросами в атмосферу огромного количества вредных веществ: оксидов азота, монооксида углерода и др. Весьма привлекательной представляется возможность использования в качестве моторного топлива спиртов. При этом значительно уменьшаются вредные выбросы. Сама проблема использования спиртов в качестве топлива не нова, и в некоторых европейских странах в 20-30-е годы были изданы законы, предписывающие добавление спирта к бензинам.
По некоторым физико-химическим свойствам (теплота сгорания, октановое число и др.) метанол приближается, а по такой важнейшей характеристике, как теплота испарения, даже превосходит лучшие углеводородные топлива. Однако высокая гидрофильность метанола, токсичность, агрессивность по отношению к некоторым металлам, небольшая теплоемкость сдерживают его применение для двигателей внутреннего сгорания. К тому же использование метанола в качестве чистого топлива требует значительного переоборудования двигателей. Более экономичным путем представляется, поэтому переработка метанола в бензин. Процесс образования бензина из метанола на катализаторе ZSM-5 протекает через стадию дегидратации метанола в диметиловый эфир, который далее превращается в смесь углеводородов (бензин), состоящую более чем на 50% из ценных высокоразветвленных парафинов: 2CH3OH и CH3OCH3. В настоящее время серьезно рассматривается проблема использования метанола в качестве добавок к топливу для энергетических установок. Помимо использования метанола как горючего отметим его применение в качестве сырья для получения высокооктановых добавок к бензину, прежде всего метил-трет-бутилового эфира (МТБЭ), который вытеснил в этом качестве токсичный тетраэтилсвинца. Добавление небольших количеств этого антидетонатора позволяет использовать бензины без подмешивания к ним такого токсичного вещества, как тетраэтилсвинец. МТБЭ, промышленное производство которого в мире быстро растет, получают взаимодействием метанола с изобутиленом в присутствии кислых катализаторов:
МЕТАНОЛ ДЛЯ ГАЗОПЕРЕКАЧКИ
По прогнозам к 2005 году более 50% всей добычи газа в РФ будет сосредоточено в районах Крайнего Севера. Для предотвращения закупорки магистральных газопроводов и подземных газохранилищах кристаллогидратами при низких температурах воздуха в перекачиваемый газ необходимо вводить метанол. Потребность предприятий РАО «Газпром» в метаноле, удаленных от ентров его производства, составляет более 250тыс.т/год, в т.ч., в районе Уренгоя 80-82 тыс.т/год. Предполагается, что в связи с развитием масштабов добычи газа в районах крайнего севера в зонах вечной мерзлоты потребление метанола будет возрастать. Доставка метанола на промыслы Крайнего Севера как минимум удваивает его стоимость, а для некоторых месторождений, в частности Ямала, вообще отсутствует возможность его доставки. Решением указанной проблемы может быть создание легко транспортируемых малотоннажных (производительностью 5000 — 20000 тонн метанола в год) установок для организации производства метанола непосредственно в районах газодобычи.
ЗАКЛЮЧЕНИЕ
Представленный материал позволяет заключить, что в будущем синтез-газ станет основным сырьевым ресурсом химической промышленности. Если цены на ископаемое сырье меняются в ряду нефть > природный газ > уголь, то их запасы располагаются в обратной последовательности. За последние годы в исследованиях в области синтезов на основе СО и Н2 достигнуты впечатляющие успехи, тем не менее в некоторых случаях разработанные процессы требуют жестких условий — высоких температур и давлений, что ограничивает их широкое промышленное использование. Поэтому крайне актуальной становится задача создания новых активных и селективных катализаторов, позволяющих осуществлять реакции синтез-газа в мягких условиях. Химикам предстоит выполнить огромную работу не только по созданию новых катализаторов, но и по разработке новых процессов, повышающих ресурсо- и энергоотдачу. Нет сомнений, что фундаментальные исследования в этом направлении послужат основой для будущих открытий.
energosintop.narod.ru
Производство метанола | Полезное своими руками
Краткие сведения о метаноле
Если посмотреть в Википедии, метанол (метиловый спирт, древесный спирт, карбинол, СН3ОН) — простейший алифатический спирт, бесцветная жидкость со слабым запахом, напоминающим запах этилового спирта.
Температура кипения: +64,5°C, температура замерзания: —97,8°C, плотность: 792 г/л.
Пределы взрывоопасных концентраций в воздухе 6,7—36% по объему. Октановое число больше 110.
Температура воспламенения 467°C, теплота сгорания 24000 кДж/кг — меньше, чем у бензина (44000 кДж/кг), поэтому расход метанола (в литрах) будет выше примерно в два раза.
Как топливо применяется в гоночных машинах, например в Формуле-1.
Метиловый спирт смешивается в любых концентрациях с водой и органическими растворителями.
Метанол и его пары ядовиты: выпитые 30 миллилитров метанола могут быть СМЕРТЕЛЬНЫ, если не принять срочных мер!
Традиционно метанол получали возгонкой древесины. Но более перспективен способ получения метанола — из природного газа. В дальнейшем по мере совершенствования этой технологии возможны и другие источники сырья, например биомасса (навоз).
Промышленные способы получения метилового спирта пока недостаточно эффективны для использования метанола в качества топлива, но если в ближайшие десятилетия цена на нефть будет подниматься, то ситуация может изменится в пользу спиртового топлива (особенно при использовании автомобилей на топливных ячейках).
Природный газ, как известно, почти на 100% состоит из метана — СН4. Ни в коем случае не надо его путать с баллонным газом пропан-бутаном, последний является продуктом крекинга нефти и используется напрямую в качестве автомобильного топлива.
Можно перевести любой автомобиль с бензиновым двигателем на смесь пропана и бутана, достаточно установить соответствующее оборудование. А при использовании метанола даже не потребуется никакого дополнительного оборудования.
Мы подробно опишем, как, используя метанол в качестве топлива, как можно существенно повысить мощность двигателя. Пока же только скажем, что это достигается увеличением диаметра главных жиклеров или уменьшением количества воздуха в топливной смеси.
Итак, поговорим немного о химии процесса получения метанола из природного газа.
Метан при неполном окислении превращается в окись углерода и водорода, реакция эта выглядит следующим образом:
2СН4+О2 —> 2СО + 4Н2 + 16,1 ккал.
Более простой технологически способ проходит по реакции конверсии метана с водяным паром:
СН4 + Н2O —> СО + 3Н2 — 49 ккал.
В первом уравнении стоит +16,1 ккал. Это означает, что реакция идет с выделением тепла. Во втором — с поглощением. Тем не менее, мы остановимся на втором способе получения окиси углерода и водорода.
При наличии этих двух компонентов уже можно напрямую синтезировать метанол. Реакция идет по следующей формуле:
СО + 2Н2 <=> СН3ОН.
Сложность в том, что конечный продукт получается лишь при высоком давлении и температуре (Р>20 атм, Т=350°C), но при наличии катализатора этот процесс смещается вправо и при низком давлении.
Полученный метанол выводится из реакции охлаждением до конденсации, а не сконденсировавшие газы будем сжигать. При правильном сжигании остатков водорода и СО никаких вредных веществ не выделяется (отходы СО2 и Н2O — безвредны), так что никаких вытяжных устройств не требуется.
Дальше метанол заливается через трубку, обязательно с герметизацией (!), в канистру.
Как видите, химический процесс очень прост, он основывается на двух реакциях.
Сложности есть только технологические и по мерам безопасности. Мы ведь здесь имеем дело с сильно горючими и ядовитыми веществами. Нужно опасаться как взрыва, так и утечки этих газов. Поэтому необходимо строжайше соблюдать технологию и правила техники безопасности, которые мы будем описывать.
Для сборки установки нужно будет приобрести: лист нержавеющей стали (1мм), трубку из «нержавейки» бесшовную, наружным диаметром 6—8 мм, толщиной стенок не менее 1 мм и длиной около 2 метров, компрессор от любого бытового холодильника (можно со свалок, но рабочий). Ну и, само собой разумеется, нужна будет аргоновая электросварка.
Для производительности 10 л/час теплообменник может быть длиной 600 мм, а для 3 л/час должно хватить и 200 мм, h — 20 мм. Размеры частиц могут варьироваться, оптимум где-то в пределах 0,5—1 мм.
ТЕПЛООБМЕННИКИ
Теплообменники обычно состоят из трубок, окруженных охлаждающей средой. В обиходе их называют «змеевиками».
Для жидкостей, теплопроводность которых велика, такой теплообменник может быть приемлем. Но с газами ситуация совершенно другая.
Дело в том, что на небольших скоростях поток газа движется ламинарно и практически не обменивается теплом с окружающей средой.
Посмотрите на дымок, подымающийся от горящей сигареты. Эта стройная струйка дыма и есть ламинарный поток. Сам факт того, что дымок поднимается вверх, говорит о его высокой температуре. А то, что он остается цельным прутком примерно на высоту до 20 сантиметров подъема, свидетельствует о сохранении им тепла. То есть на этом расстоянии даже при совсем малых скоростях поток газа не успевает охладиться, обменяться теплом с воздухом.
Именно вследствие ламинарности потока газовые теплообменники всегда получаются очень громоздкими.
Внутри трубок теплообменников появляются «сквозняки», которые даже на десятках метров практически не дают теплообмена.
Это хорошо известно тем, кто когда-либо гнал самогон. Длинная, интенсивно охлаждаемая трубка, из неё вытекает конденсат, но при этом обязательно идет и пар. Значит, теплообмен недостаточно эффективен.
Проблема, однако, имеет решения и оно может быть несложным. Например, наполнить трубку медным порошком (см. рис.1).
Учитывая задачи теплообмена, материалом корпуса могут быть и железо, и медь, и алюминий, материалом набивки — медь, алюминий, — что найдется. Тогда вокруг каждой частички металла струйка газа будет образовывать завихрения.
Тем самым сразу ликвидируются сквозняки и поток становится турбулентным. Ну и одновременно увеличивается в огромной степени контакт газа с охлаждаемой поверхностью.
С уменьшением размеров и увеличением количества частиц медного порошка растет сопротивление газовому потоку. Поэтому не стоит использовать для теплообменника частицы мельче 0,5—1 мм.
Набитый в трубку порошок меди постоянно принимает или отдает тепло стенкам, и поскольку теплопроводность меди примерно в 100 тысяч раз выше теплопроводности газа, то газ сравнительно быстро примет температуру стенок, если мы будем их интенсивно охлаждать.
Проточную охлаждающую воду, конечно, целесообразно пропускать навстречу потоку газа. Это дает возможность в каждый точке теплообменника иметь свою определенную температуру. Поскольку тепловой контакт у нас близок к идеальному, температура на выходе конденсируемой жидкости будет равна температуре охлаждающей жидкости.
Вот каков по идее обсуждаемый здесь теплообменник.
Приведенный эскиз есть не что иное, как дистиллятор, он же самогонный аппарат, он же теплообменник. Производительность такого дистиллятора приблизительно 10 литров в час. Его также можно применять практически в любых целях, включая установку для получения этилового спирта.
Такие теплообменники при огромной производительности в сотни раз меньше существующих.
КАТАЛИТИЧЕСКИЙ НАСОС-РЕАКТОР
В существующих химических газовых процессах обычный катализатор идет в гранулах довольно значительного размера от 10 до 30 мм.
Площадь контакта газа с такими шариками в тысячи раз меньше, чем если бы мы использовали частицы в 1—1000 микрон. Но тогда проходимость газа весьма затруднится.
Кроме того, мельчайшие частицы катализатора довольно скоро выйдут из строя вследствие поверхностного загрязнения.
Нами найден способ увеличить площадь контакта газа с катализатором, не затрудняя проходимости его в реакторе, и одновременно непрерывно производить очистку от так называемого «отравления» самого катализатора. Делается это следующим образом.
Порошковый катализатор смешивается с ферромагнитными частицами — железным либо ферритовым порошком, который можно получить, разбивая магниты от неисправных громкоговорителей.
Ферриты теряют магнитные свойства при температуре выше 150 градусов. Поэтому никогда не допускайте их перегрева.
Ферриты очень твёрдое вещества — это их полезное свойство пригодится в дальнейшем и позволит обойтись без добавления абразивного порошка (об этом далее).
Смесь ферромагнитного порошка с катализатором помещается в немагнитную трубку, например, из стекла, керамики, можно и в алюминиевую или медную.
Теперь смотрите, какая может быть схема.
Снаружи трубки идут обмотки катушек. Каждая из них включена через диоды, так, например, как дано на рис.3.
При включении в сеть переменного тока обмотки включаются поочередно с частотою 50 Гц. При этом ферромагнитный порошок непрерывно сжимает и расширяет катализатор, обеспечивая пульсирующую проходимость газа.
Если же включать электромагниты в трехфазною сеть (см. рис.4), то в этом случае обеспечивается поступательная пульсация сжатий, и за счет этого непрерывно газ будет сжиматься в продольном направлении вперед.
Таким образом, система работает, как насос. При этом — многократно перемешивая газ, сжимая и расширяя его и тысячекратно увеличивая интенсивность процесса на катализаторе.
Попутно частички катализатора трутся друг о друга и о ферритовый абразивный порошок, что приводит к их очистке от загрязняющих пленок.
Схема работает следующим образом: с частотой 50 Гц происходит смена полярности на питании. Ток попеременно проходит по обмотке 1,3 и 2,4 (см. рис. 2). При этом в них появляется магнитное поле, которое намагничивает ферромагнитные частицы и заставляет их взаимодействовать друг с другом, вовлекая в движение частицы катализатора.
Таким образом попеременно возникает для газа проходимость сквозь мелкие частицы, сменяемая большим сопротивлением, оказываемым сдавленной массой частиц.
Активность катализатора, сжимающего и разжимающего реагирующий газ, по еще не изученным причинам дополнительно повышается в 20—50 раз. По всей видимости, эффекты усилятся при подаче прямоугольных импульсов или колебаний высокой частоты.
Работа описанного каталитического реактора эквивалентна реактору размером метров в 20—30. Увеличить производительность реактора можно, включая обмотки в трехфазную сеть. При этом система работает не как клапаны, а как активный насос, совмещая все положительные эффекты первой схемы и дополнительно принуждая газ перемещаться в направлении смещения сдвига фаз. При таком включении важно правильно выбрать фазировку.
Итак, в реакторе, приведенном здесь, работают следующие положительные факторы:
- Увеличение площади катализатора в 300—1000 раз за счет уменьшения размеров частиц.
- Происходит постоянная очистка катализатора от поверхностного загрязнения.
- Постоянные пульсации давления реагирующих газов между частицами катализатора, а во второй схеме дополнительно происходит еще и перекачки газа внутри самого реактора.
Недостаток этого реактора — повышенное сопротивление потоку газа. Это устраняется попеременным уплотнением/освобождением частиц внутри четных/нечетных катушек.
Одна важная деталь: необходимо теплоизолировать катушки от корпуса реактора.
В связи с этим, а также из практических соображений автором сайта были внесены следующие изменения (см.рис.справа).
Корпус реактора вытачивается из латунной или бронзовой болванки диаметром 50 мм. Размеры можно взять прежние — 160 мм общая длина, рабочая реакторная длина около 140 мм, внутренний диаметр 33 мм, толщина стенок приблизительно 5…8 мм, т.е. внешний диаметр около 50 мм и того же диаметра — заглушки, их толщина по 20 мм и на каждой нарезана резьба М36х1,0 мм и длиной по 10 мм.
Всё это должно быть сделано из одного и того же материала!
К заглушкам в отверстия вставляются и привариваются переходные штуцера или просто соединительные бесшовные стальные трубки с внутренним диаметром 6…8 мм и толщиной стенок около 2 мм.
Данную конструкцию необходимо снаружи теплоизолировать листовым асбестом и разделить по всей длине на четыре секции с помощью пяти перегородок, также вырезанных из листового асбеста.
Для фиксации перегородок их можно промазать силикатным клеем. После просушки наматывается медная проволока (d=0,15мм) в каждую секцию.
Сопротивление, измеренное омметром, для каждой секции должно быть около 1200 Ом.
Обмотки включаются по схеме рис.3 через регулятор напряжения, например, лабораторный трансформатор (ЛАТР).
Чтобы избежать перегрева обмоток, их надо охлаждать, для этого можно проложить под обмотки стеклянные трубочки диаметром 6…8 мм, возможен принудительный обдув катушек, с контролем температуры внутри реактора.
Следует отметить, что подобная схема реактора на рис. 2 была заявлена на патент ее автором — гражданином Г.Н. Вакс. Она может работать в любых каталитических газовых процессах.
Для профессиональных химиков данная схема — это не домашняя разработка, а принципиально новый, еще не совсем изученный, но эффективный реактор.
Производство синтез-газа
Синтез-газом называется смесь H2 и СО, необходимая для производства метанола.
Вначале рассмотрим технологию синтез-газа.
Традиционные методы получения СО и H2 из метана (CH4) состоят в том, что метан смешивается с водяным паром и в нагретом состоянии поступает в реактор, где к паро-метанной смеси добавляется дозированное количество кислорода. При этом происходят следующие реакции:
- СН4 + 2O2 <—> СО2 + 2Н2О + 890 кДж ;
- СН4 + Н2O <—> СО + ЗН2 — 206 кДж ;
- СН4 + СО2 <—> 2СО + ЗН2 — 248 кдж ;
- 2Н2 + O2 <—> 2Н2О + 484 кдж ;
- СО2 + Н2 <—> СО + Н2O — 41,2 кДж.
Как видно, некоторые реакции эндотермические (т.е. с поглощением тепла), а некоторые экзотермические. Наша задача создать такой баланс, чтобы реакции шли с контролируемым выделением тепла.
Итак, вначале требуется дозированное смешение Н2О и СН4.
Традиционные методы ведения этого процесса сложны и громоздки. Мы будем насыщать метан водяными парами путем пропускания пузырьков этого газа через нагретую до 100 градусов Цельсия воду, а чтобы пузырьки активно разбивались, размещаем на их пути твердые ферритовые частички размером 1—2 мм.
Но в этой массе рано или поздно пузырьки находят дорогу и затем, практически не разбиваясь, проходят по образовавшемуся каналу. Чтобы этого не происходило, частички из феррита и смесительную камеру ставим в соленоид с подачей переменного тока.
В этом и заключается существенное отличие нашего диспергатора от традиционных устройств (см.рис 5).
Диспергатор
Это такое устройство, в котором метан насыщается парами воды.Под действием вибрации частиц феррита в пульсирующем магнитном поле пузырьки метана постоянно разбиваются, проходят сложный зигзагообразный путь и насыщаются парами воды.
К соленоиду жестких требований нет, поскольку запитывается он от ЛАТРа или от какого-либо из имеющихся в продаже регуляторов света.
Регулировка напряжения на соленоиде необходима, чтобы, изменяя магнитное поле, одновременно изменять и степень насыщения метана парами воды. О цели этих изменений будет сказано ниже.
Количество витков в катушке может быть от 500 до 1000. Диаметр провода 0,1— 0,3мм. Труба диспергатора берется из неферромагнитного металла, поэтому в переменном магнитном поле она будет разогреваться. Кроме того, и метан поступает в воду разогретым.
Но не смотря на это, воду все равно требуется предварительно нагревать до кипения, иначе не получить нужного количества водяного пара.
Ещё необходим бачок для подпитки водой, поскольку она непрерывно расходуется на образование паро-метановой смеси, для этой цели подойдет сливной бачок от стандартного унитаза, чьё сливное отверстие закрывается стальной пластиной, с приваренной сливной трубкой, конец этой трубки вставляется в диспергатор и изгибается вниз на 180° (см. рис. 5).
Делается это с целью безопасности, чтобы исключить попадание газа-метана в бачок.
Готовая паро-метановая смесь разогревается до температуры 550—600 градусов в теплообменнике.
Необходимо расположить бачок таким образом, чтобы уровень воды в смесителе—диспергаторе не поднимался выше 150 мм, т.е. до половины его высоты, это связано с величиной давления в газовой сети (=150 мм водного столба!), иначе вода будет препятствовать проходу газа-метана в диспергатор.
Также воду перед подачей в бачок необходимо очистить от примесей хлора. С этим справятся стандартные средства очистки воды для бытовых целей.
Готовая паро-метановая смесь разогревается до температуры 550—600 градусов в теплообменнике. Устройство теплообменника (см. рис. 6) уже достаточно подробно было описано выше (см. рис.1). Поэтому приведем только уточнение размеров.
Теплообменник изготавливается из нержавеющей стали, обязательно варится в среде инертного газа. Трубки из нержавеющей стали крепятся к корпусу только сваркой.
Наполнитель теплообменника изготовляется из 1—2 миллиметровых частиц керамики. Это может быть, например, дробленая фарфоровая посуда. Наполнять емкость надо достаточно плотно, с обязательным встряхиванием.
Возможная ошибка: при недостаточном наполнении теплообменника частицами керамики газ найдет себе дорогу, и потоки будут ламинарными, чем ухудшается теплообмен.
ВНИМАНИЕ: вся система должна быть герметична и не допускать никаких утечек! Так как в теплообменнике поддерживается очень высокая температура, нельзя применять какие-либо уплотнители — только аргонная сварка.
Самым сложный и ответственным узлом является конвертор-реактор (рис. 7). В нем собственно и происходит конверсия метана (превращение его в синтез-газ).
Конвертор состоит из кислород-паро-метанового смесителя и реакционных каталитических колонн. Вообще, реакция идет с выделением тепла. Однако в нашем случае, чтобы процесс начался, на подводящих трубках необходим нагрев, поскольку мы осуществляем конверсию метана по реакции:
СН4 + Н2О <—> СО + ЗН2 — 206 кДж , с потерей тепла,
а значит нужно обязательно подводить тепло в конвертор. Для этого паро-метановый газ мы пропускаем через трубки, обогреваемые горелками.
Конвертор работает следующим образом: паро-метановая смесь поступает в камеру, в которой вварены трубки из нержавеющей стали. Количество трубок может быть от 5 до 20 в зависимости от желательной производительности конвертора.
Пространство верхней камеры должно быть обязательно плотно набито крупнозернистым песком или дробленой керамикой или крошкой нержавейки, размеры частиц 0,5—1,5 мм. Это необходимо для лучшего перемешивания газов, а самое главное — для пламягашения.
При соединении воздуха с горячим метаном может произойти загорание. Поэтому в верхней камере набивка осуществляется с обязательным встряхиванием и досыпкой.
Трубки и сборная камера (на рис. 7 — нижняя), как раз и набиваются частицами, содержащими катализатор — окись никеля. Массовая доля никеля в катализаторе при пересчете на NiO, должна составлять не менее 7,5±1,5%.
Остаточное содержание метана при конверсии с водяным паром природного газа (соотношение пар:газ=2:1), при температуре 500°С — 38,5%, а при 800°С — не более 1,5%.
Массовая доля «вредной» серы в пересчете на SОз, должна быть не более 0,005%.
В качестве катализатора лучше всего использовать готовый промышленный, но в крайнем случае можно сделать его самостоятельно.
Для этого нужно на воздухе прокалить частицы никеля. Если чистого никеля нет, то можно его приготовить из никель-содержащих 10—15—20-копеечных монет СССР.
Сотрите их на грубом абразивном круге или мелкой фрезой. Попадание абразива в набивку допускается. Полученный порошок прокалите и смешайте в пропорции 1/3 объема порошка с 2/3 объема молотой керамики (0,5 мм) или чистого грубозернистого песка.
Чтобы не перегревать верхнюю камеру, промежуток между верхними частями трубок заполняются на 10 см любым высокотемпературным теплоизолятором.
Простой способ получения теплоизолятора: обычный канцелярский силикатный клей смешивают с 10—15 весовыми процентами тонкомолотого мела или талька или глины. Перемешивают тщательно.
Наливают смесь тонким слоем и сразу же прижигают огнем паяльной лампы.
Вскипевшая в клее вода образует пемзообразную белую массу. Когда она остынет, опять наливают на нее слой клея с мелом и опять обрабатывают пламенем.
И так повторяют до тех пор, пока не получат, необходимый слой теплоизолятора. В итоге покрытие получается похожим на профессиональную теплоизоляцию центрального отопления:
После окончания сборки конвертора его помещают в стальной короб, которой обязательно теплоизолируют материалом, выдерживающим температуру до 1000 градусов, например, асбестом.
Горелки инжекционного типа, могут быть любые, от 5 штук до 8. Чем их больше, тем равномернее нагрев. Возможна также система, использующая одну горелку. Пламя ее имеет несколько выходов через отверстия в трубе.
Газовые горелки есть в продаже, например, те, что используются для обработки лыж. Есть в продаже также газовые паяльные лампы, поэтому мы даем только общую схему.
Горелки должны соединяться параллельно и регулироваться стандартным газовым краном, например, от газовой плиты, но лучше взять автоматический регулятор от бытовой газовой плиты — дороговат, но надёжен и удобен — с его помощью можно задать нужную температуру внутри конвертора-реактора, повысив тем самым степень автономности установки в целом.
Эжекторный смеситель
Эжекторный смеситель подачи воздуха и метана в камеру конвертора (см.рис.8.) — это еще один из ответственных узлов.
Смеситель состоит из двух сопел одно подает метан, насыщенный парами воды, а другое — эжектор воздуха. Воздух поступает от компрессора , количество его регулируется клапаном давления (рис. 9).
Компрессор может быть практически от любого бытового холодильника, давление регулируется от «нуля» до необходимого, которое будет не на много выше давления в газовой магистрали (т.е. => 150 мм. вод. ст.).
Необходимость подачи воздуха (кислорода) в конвертор обусловлена тем, что по реакции [5] часть водорода должна быть поглощена с выделением СО, тем самым увеличивается количество окиси углерода до пропорции СО:Н2 = 1:2, т.е. число молей (объемов) водорода должно быть в два раза большим объемов окиси углерода.
Наличие избыточного воздуха приведёт к синтезу побочных продуктов — кислот, высших спиртов — «сивухи» и прочих вредных компонентов.
Но возникновение CO2 произойдет по реакции [1] с выделением большого количества тепла. Поэтому вначале процесса компрессор мы не включаем и винт держим вывернутым. Воздух не подаем. И по мере разогрева камеры и включении всей системы будем постепенно, включив компрессор и вворачивая винт клапана давления, увеличивать подачу воздуха и одновременно уменьшать пламя на горелках.
Контроль будем вести по количеству излишков водорода на выходе из конденсатора метанола (теплообменник 3. и 3.1) через фитиль(13, рис. 10), сокращая его.
Фитиль для дожига излишка синтез-газа представляет собой 8-миллиметровую трубку, длиной 100 мм, набитую медным проводом по всей длине, чтобы пламя не пошло вниз, в канистру с метанолом.
Мы разобрали все узлы установки получения метанола.
Как ясно из предыдущего, вся установка состоит из двух основных узлов: конвертора для создания синтез-газа (конверсия метана) и синтезатора метанола. Синтезатор (каталитический насос, см. рис. 2) достаточно хорошо описан выше. Единственно, что следует добавить — это необходимость установки теплоизолятора между трубой и катушкой. Как изготовить теплоизолятор, мы рассказывали чуть выше.
Общая схема установки
Работа общей схемы: из газовой магистрали метан поступает через вентиль (14) в теплообменник (3.1), разогревается до 250—300°C, затем поступает в фильтрующий реактор (15), который работает по принципу каталитического насоса (как на рис.2, только диаметр трубы — 8см) и содержит в себе окись цинка — для очистки газа от примесей серы и лишь затем газ поступает в смеситель-диспергатор (2), где насыщается парами воды.
Вода (дистиллированная) добавляется в диспергатор непрерывно из бачка (1).
Вышедшая газовая смесь поступает в теплообменник (3.2), где разогревается до 500—600°C и идет в конвертор (4). На катализаторе при температуре 800°C происходит реакция [2]. Для создания этой температуры работают горелки (12).
После установления температурных режимов включается компрессор (5) и постепенно подается воздух в смеситель (11).
Повышение давления осуществляется путем вворачивания винта в клапане (8). Одновременно уменьшаем пламя на горелках (12) при помощи вентиля (14.2).
Полученный на выходе синтез-газ поступает в теплообменники (3.1; 3.2), где охлаждается до температуры 320—350°. Затем синтез-газ поступает в синтезатор метанола (6), где на катализаторе из смеси одинакового количества ZnO, CuO, CoO происходит превращение его в метанол СН3ОН.
Смесь газообразных продуктов на выхода охлаждается в теплообменнике (3.3), который описан выше (см. рис. 1) и поступает в накопительный бачок (10). В верхней его части находится трубка — фитиль (13), где дожигаются продукты, которые не прореагировали в процессах.
ВНИМАНИЕ: сжигание непрореагировавших газов совершенно необходимо!
Метан через вентиль (14) поступает в теплообменник (3.1), разогревается до 250—300 градусов и поступает через реактор-фильтр (15) в смеситель—диспергатор (2), где насыщается парами воды.
Вода добавляется в диспергатор непрерывно из бачка(1). Вышедшая газовая смесь поступает в теплообменник (3.2), где разогревается до 500—600 градусов и идет в конвертор (4).
На NiO — катализаторе при температуре 800—900 градусов происходит реакция [2]. Рабочую температуру создают горелки (12).
Важные советы
Катализаторы можно готовить самому путем прокаливания порошковых металлов на воздухе.
Измерение температуры можно осуществлять при помощи термоиндикаторных красок, которые в настоящее время достаточно распространены. Измерение нужно проводить на входных и выходных трубках.
Если термокрасок вы не достанете, можно изготовить сплав олово — свинец — цинк. При определенных, найденных экспериментально, пропорциях смешения они будут иметь необходимую температуру плавления. Нанося полученные сплавы на трубки и следя за их плавлением, можно с некоторой погрешностью контролировать температуру.
Если вы не допустили образования газовых карманов (т.е. полностью заполнены все полости соответствующей крошкой), если устранили утечки и самое главное — своевременно зажжен и постоянно горит фитиль (11), то установка будет абсолютно безопасна.
Подбирая катализаторы можно повышать тепловой КПД, увеличить процент выхода метанола. Для достижения оптимума здесь требуются эксперименты. Они проводятся во многих институтах разных стран. В России к числу таких НИИ относится, например, ГИАП (Государственный институт азотной промышленности).
Следует иметь в виду, что получение метанола из природного газа в компактных установках — новое дело, и многие процессы еще недостаточно изучены. В то же время метанол — одно из самых экологически чистых и практически идеальных топлив. И, самое главное, получение его основано на безграничных и возобновляемых ресурсах — метане.
Реакция государства на публикацию этой информации
Приведем фрагмент интервью с редакцией журнала «Приоритет», где впервые была опубликована схема и теоритическое обоснование возможности получения метилового спирта в домашних условиях:
Дорогой спирт — это соблазн правительству залатать свою бездарную экономическую литику. Спирт дешев, и его искусственная дороговизна безумно дорого обходится всем нам. Так что, когда у власти находятся временщики, проблемы, им вверенные, остается решать изобретателям.
Мы научим людей делать чистый спирт практически из чего угодно.
— Вы всерьез хотите связать проблему власти с «бесплатным» автомобильным топливом?
Нам внушают идею о выравнивании цен на бензин под мировые цены. Но за месячную зарплату немецкий рабочий мог бы купить 3,3 тонны бензина, наш работяга — 220 литров. Это притом, что Германия бензин ввозит. Так что, вывозя в огромных количествах топливо и, обогащая на этом кучку дельцов, нас лишают не только будущего, но и настоящего.
Поэтому мы и пошли на публикацию технологии лучения метанола из природного газа.
— Но возникнут сложные проблемы. Нужно будет опять ставить газовые счетчики на каждую квартиру, контролировать их. том это просто опасно: ведь метанол — страшный яд.
Что касается счетчиков — это не наша проблема и не проблема граждан. Думаю, что в настоящее время проконтролировать лучение метанола в квартирах невозможно. Не смогли же тысячи участковых кончить с самогоноварением. А маленький чемоданчик, дключенный к плите и водопроводу и к тому же не издающий никаких запахов, искать безнадежно.
Что же до ядовитости метанола здесь вы абсолютно правы — 30 мл выпитого метанола, смертельны. Но и рюмка бензина ядовита не меньше. Но если выхлоп сгоревшего в двигателе бензина медленно губит все живое в городах, то выхлоп метанола абсолютно чист.
Кроме того, двигатель, работающий на метаноле, служит во много раз дольше и мощность его намного выше. Поэтому его широко ис льзуют в спортивных машинах. Знаю это как бывший мотогонщик. Самое главное для безопасности производства метанола на нашем оборудовании — точно следовать рекомендациям.

electro-shema.ru
Метиловый спирт (метанол) из чего делают и где применяют?
Во второй половине VII столетия человечество изобрело метиловый спирт, который был произведен методом сухого перегона древесины, что дало ему второе название – древесный спирт. Внешне он выглядит как прозрачная легковоспламеняющаяся жидкость, которая имеет схожий запах с обычным этилом. Легко растворяется с органическими жидкостями.
Описание продукта и его использование в жизнедеятельности человека

Сегодня продукт получают путем каталитического синтеза при 2500С из водорода и ОН, используя давление 7 мПа и определенных катализаторах (оксид цинка, меди). До начала второй половины ХХ столетия метиловый спирт получали путем сухой перегонки древесины.
На сегодняшний день такой «древесный» способ считается второстепенным и практически не используется. А с целью производства более дешевого продукта используют нефтеперегонные отходы.
Внешние характеристики метанола:
- жидкость, не имеющая цвета;
- запах схож с этиловым спиртом, но не так ярко выраженный.
Эфиры, этанол, а также вода могут легко смешиваться с ним в любых пропорциях. Метиловый спирт имеет свойство разогреваться и сжиматься при соединении с водой. При смешивании медного купороса и чистого метанола образуется жидкость с голубоватым оттенком. Отличается низкой температурой закипания – 64,50С. Метанол легко воспламеняется, а огонь имеет бледно-голубоватый с оттенком зеленого цвет.
У метанола есть несколько способов использования. В химической отрасли его применяют для производства пластмассы. Это одна из составляющих антифризов и растворителей.
Он используется и в качестве топлива. Особенно часто его применяют в спортивных автомобилях. Некоторые крупные автогиганты выпустили даже экспериментальные автомодели, которые работали на этом виде топлива.
В газовой промышленности метанол применяют в борьбе с образованием гидратов.
Метиловый спирт – это яд, действие которого распространяется после внутреннего приема и негативно влияет на нервную и сосудистую системы организма.
Метанол хоть и является одним из видов алкоголя, но потреблять его внутрь строго воспрещается. Даже в небольшом количестве он может негативно повлиять на человека. Это опасное и ядовитое вещество.
к содержанию ↑Отравление метиловым спиртом
После приема внутрь метанол даже в минимальной дозе приводит к отравлению человека. Если 5–10 мл этого спирта вызывает слепоту, то доза в 30 грамм становится смертельной. Но для каждого человека количество пагубной дозы разнится, поэтому точно сказать о ней невозможно. Длительность действия на организм длится от 6 часов до 10 суток, что также зависит от особенностей человека.
После приема вещество пагубно действует на нервную и сосудистую систему. Человек умирает в результате нарушения работы дыхательных органов, что приводит к отечности легких и головного мозга.
Отравления метиловым спиртом классифицируют на такие виды:
- Быстропротекающее отравление возникает при одновременном приеме достаточно большой дозы древесного спирта. У человека очень быстро наблюдается глухота, потеря сознания, коллапс. Летальный исход может произойти уже через 2 часа.
- Замедленный вид интоксикации может иметь легкую, среднюю и более тяжелую форму отравления.
К симптоматике легкой степени относят такие признаки:
- острая боль в голове;
- общая слабость, вялость или недомогание;
- тошнота и рвота;
- озноб.
Но реакция может быть разной. Она очень схожа с признаками отравления этилом. И во многих случаях их путают. Человек на первых этапах отравления может и не догадываться о том, что употребил яд, а свое состояние воспринимает как реакцию на опьянение. Но при отравлении метиловым спитом во многих случаях тревожные симптомы нарастают.
Метил разрушает сосуды, нервные клетки, приводит к потере остроты зрения и слепоты. Человеку после отравления метилом необходима срочная квалифицированная помощь медицинских работников.
При этом опасность для человека составляет не только чистый метил, но и применение смесей, в которых даже в минимальных дозах содержится этот компонент.
Отравление организма человека может происходить не только в результате попадания его в пищеварительный тракт, но и при вдыхании паров метанола, которые проникают через легкие. Метил имеет способность впитываться через кожные покровы.
После попадания внутрь он всасывается тканями, распределяясь по всему организму. Наибольшее его количество концентрируется в почках, желудке, кишечнике, а наименьшее его – в мышцах и жировой ткани, мозге.
У человека, который отравился метанолом, концентрация вещества в крови находится в пределах от 74 до 100 мг/куб. дм. Если отравление метанолом привело к смертельному исходу, то количество метанола в сыворотке крови составляет более 100 мг/куб.дм. Но такие показатели не являются догмой, так как смерть наступала и при других значительно меньших показателях, что, возможно, связано с прошествием времени, с момента потребления токсического вещества.
Потребление яда может быть целенаправленным или непредумышленным. Сегодня все чаще можно услышать, что люди отравились после потребления водки. После исследований продукта выяснилось, что это фальсификат, и в его состав добавлен метиловый спирт.
При первых проявлениях отравления метилом, должна быть быстрая реакция, направленная на очистку желудка от остатков не всосавшегося спирта путем искусственного вызывания рвоты.
Отравившемуся нужны кислородные ингаляции. В домашних условиях, при отсутствии кислородной маски, его нужно вывести на свежий воздух. Прием активированного угля в этом случае оказывается не эффективный. Также очень важно быстро обратиться в медицинское учреждение для промывания и назначения лечения.
Терапия таких больных проводится двумя антидотными средствами:
- этиловый спирт (не применяйте в домашних условиях!) действует как нейтрализатор метанола, не позволяя ему метаболизироваться в печени;
- метилпиразол – алкогольдегидрогиназ.
Этиловый спирт, разведенный с глюкозой, при отравлении метиловым спиртом назначают внутривенно в более тяжелых стадиях интоксикации. При этом придерживаются определенной дозировки, которая назначается в соответствии с состоянием пациента. Первая доза вводится внутрь через зонд или дается выпить, если пострадавший в сознании.
к содержанию ↑Как правильно различать?
К большому сожалению, определить, что именно перед вами: этиловый или метиловый спирт практически невозможно. Особенно тяжело определить метил, если он входит в состав другого алкогольного продукта.
В домашних условиях есть два способа выявить древесный спирт.
Для этого нужно приготовить:
- емкость металлическую;
- градусник;
- проволоку медную;
- емкость прозрачную.
В металлическую емкость наливается жидкость и ставится на газовую горелку. Метиловый спирт должен закипать при температуре 640С, а реакция этанола наступает при 780С. Это будет первый способ определить, что перед нами.
Второй способ – при помощи медной проволоки. Ее необходимо раскалить добела, после чего окунуть в исследуемую жидкость. Далее, очень осторожно принюхиваемся к парам. Этанол имеет более приятный аромат, чем-то напоминающий яблоки. Если перед вами метанол, то испарения будут иметь раздражающий запах.
Но такой вид определения может быть применен только к неразбавленным спиртам.
Для выявления наличия метила проводят такое испытание – поджигание. Часть испытуемого материала необходимо налить в посуду и поджечь. Если перед вами этиловый спирт, то пламя будет синего цвета. Если в составе есть метиловый спирт, то он даст зеленоватый оттенок.
Для определения состава алкогольной продукции применяют сырой картофель. Для этого эксперимента в посудину с исследуемой жидкостью вкладывают кусочек этого корнеплода. Реакция на метанол по прошествии нескольких часов даст выраженный розовый оттенок. Если существенных изменений в цвете нет, то ваш продукт не содержит примесей метилового спирта.
Поэтому определить, нет ли в алкоголе метила практически невозможно. Но существует ряд правил, которые минимизируют возможность вхождения в состав этого ядовитого вещества. Как же не попасть на фальсификат и не отравиться метиловым спиртом.
Обращайте внимание на происхождение продукта. Покупайте только сертифицированный товар в точках, которые проверены и не занимаются продажей фальсификатов.
Лучше закупать продукцию в специализированных алкомаркетах, а не в небольших ларечках. Также обращайте внимание на стоимость. Если она намного ниже других, то от покупки такого продукта лучше отказаться.
alcogolizm.com
Метанол
Министерство науки и образования Рф ПСКОВСКИЙ ГОСУДАРСТВЕННЫЙ университет Кафедра техносферная безопасность |
Первичный токсиколого-гигиенический паспорт на Метанол |
Выполнил студент: Медведев М.А группа:0033-04 ММФ Проверил: Пак Т.С
Метано́л (метиловый спирт, древесный спирт, карбинол, метилгидрат, гидроксид метила) — CH3OH, простейший одноатомный спирт, бесцветная ядовитая жидкость. Метанол — это первый представитель гомологического ряда одноатомных спиртов.
С воздухом в объёмных концентрациях 6,72—36,5 % образует взрывоопасные смеси (температура вспышки 15,6 °C). Метанол смешивается в любых соотношениях с водой и большинством органических растворителей.
Получение
До 1960-х годов метанол синтезировали только на цинкхромовом катализаторе при температуре 300—400 °C и давлении 25—40 МПа (= 250—400 Бар = 254,9—407,9 кгс/см²). Впоследствии распространения получил синтез метанола на медьсодержащих катализаторах (медьцинкалюмохромовом, медь-цинкалюминиевом или др.) при 200—300 °C и давлении 4—15 МПа (= 40—150 Бар = 40,79—153 кгс/см²).
Современный промышленный метод получения — каталитический синтез из оксида углерода(II)(CO) иводорода(2H2) при следующих условиях:
температура — 250 °C,
давление — 7МПа (= 70 атм= 70 Бар = 71,38 кгс/см²),
катализатор— смесь ZnO (оксид цинка) и CuO (оксид меди(II)):
До промышленного освоения каталитического способа получения метанол получали при сухой перегонке дерева (отсюда его название «древесный спирт»). В данное время этот способ имеет второстепенное значение.
Также известны схемы использования с этой целью отходов нефтепереработки, коксующихся углей.
CO2 + 3H2 <—> CH3OH + H2O + 49.53 кДж/моль
H2O + CO <—> CO2 + H2 + 41.2 кДж/моль
Молекулярная формула — CH4O или CH3—OH, а структурная: В настоящее время метиловый спирт получают синтетическим способом из монооксида углерода и водорода при температуре 300—400 °C и давления 300—500 атм в присутствии катализатора — смесиоксидов цинка, хрома и др. Сырьем для синтеза метанола служитсинтез-газ(CO + H2), обогащенный водородом: :CO+ 2H2 → CH3OH[1]
Крупнейшим производителем метанола в России является ОАО «Метафракс» в Губахе.
На конец 2013 года германский концерн «GELSENCHEM Chemical Products GmbH» предлагает метанол 98,5% по цене 520euro за 10 тонн и это цена с доставкой по Германии.
Применение
В органической химии метанол используется в качестве растворителя.
Метанол используется в газовой промышленности для борьбы с образованием гидратов (из-за низкой температуры замерзания и хорошей растворимости). В органическом синтезе метанол применяют для выпуска формальдегида, формалина, уксусной кислоты и ряда эфиров (например, МТБЭ и ДМЭ), изопрена и др.
Наибольшее его количество идёт на производство формальдегида, который используется для производства карбамидоформальдегидных и фенолформальдегидных смол. Значительные количества CH3OH используют в лакокрасочной промышленности для изготовления растворителей при производстве лаков. Кроме того, его применяют (ограниченно из-за гигроскопичности и отслаивания) как добавку к жидкому топливу для двигателей внутреннего сгорания. Используется в топливных элементах.
Благодаря высокому октановому числу, что позволяет увеличить степень сжатия до 16[источник не указан 380 дней] и большей на 20 % энергетической мощностью заряда на основе метанола и воздуха, метанол используется для заправки гоночных мотоциклов и автомобилей. Метанол горит в воздушной среде, и при его окислении образуется двуокись углерода и вода:
Для получения биодизеля растительное масло переэтерифицируется метанолом при температуре 60 °C и нормальном давлении приблизительно так: 1 т масла + 200 кг метанола + гидроксид калия или натрия.
Во многих странах метанол применяется в качестве денатурирующей добавки к этанолу при производстве парфюмерии. В России использование метанола в потребительских товарах запрещено.
При добыче газа гидраты могут образовываться в стволах скважин, промысловых коммуникациях и магистральных газопроводах. Отлагаясь на стенках труб, гидраты резко уменьшают их пропускную способность. Для борьбы с образованием гидратов на газовых промыслах вводят в скважины и трубопроводы различные ингибиторы (метиловый спирт, гликоли).
Работа топливных элементов основана на реакции окисления метанола на катализаторе в диоксид углерода. Вода выделяется на катоде. Протоны (H+) проходят через протонообменную мембрану к катоду где они реагируют с кислородом и образуют воду. Электроны проходят через внешнюю цепь от анода к катоду снабжая энергией внешнюю нагрузку.
Реакции:
На аноде CH3OH + H2O → CO2 + 6H+ + 6e−
На катоде 1.5O2 + 6H+ + 6e− → 3H2O
Общая для топливного элемента: CH3OH + 1,5O2 → CO2 + 2H2O
Получение муравьиной кислоты окислением метанола:
Получение диметилового эфира дегидратацией метанола при 300—400 °C и 2-3 МПа в присутствии гетерогенных катализаторов — алюмосиликатов — степень превращения метанола в диметиловый эфир — 60 % или цеолитов — селективность процесса близка к 100 %. Диметиловый эфир (C2H6O) — экологически чистое топливо без содержания серы, содержаниеоксидов азота в выхлопных газах на 90 % меньше, чем у бензина. Цетановое число диметилового дизеля более 55, при том что у классического нефтяного 38-53.
Метил-трет-бутиловый эфир получается при взаимодействии метанола с изобутиленом в присутствии кислых катализаторов (например, ионообменных смол).
Метил-трет-бутиловый эфир (C5H12O) применяется в качестве добавки к моторным топливам, повышающей октановое число бензинов (антидетонатор). Максимальное законодательное содержание МТБЭ в бензинах Европейского союза — 15 %, в Польше — 5 %. В России в среднем составе бензинов содержание МТБЭ составляет до 12 % для АИ92 и до 15 % для АИ95, АИ98.
studfiles.net
Конечные продукты на основе метанола и типичные направления их применения
Современные направления использования метанола. Метанол, как один из важнейших видов сырья для химической промышленности.
В 2004 г. ежегодное производство метанола превысило 32 млн. т. Это огромное количество используют как промежуточный продукт для получения разнообразных химических продуктов и материалов. Химические продукты и материалы, получаемые из метанола, представлены на рис. 1.
Из 70% метанола, произведенного во всем мире, около 38% используется для получения формальдегида, 20% — метил-трет-бутилового эфира (МТБЭ) и 11% — уксусной кислоты (рис. 2). Метанол служит также сырьем для выпуска хлорметанов, метиламинов, метилметакрилата, диметилтерефталата и т. д. Эти химические интермедиаты затем подвергаются дальнейшей обработке с целью изготовления многочисленных продуктов ежедневного обихода, таких как краски, органические и кремнийорганические полимеры, клеи, антифризы и пластмассы. Больше всего метанола расходуется на производство формальдегида, который используется главным образом для изготовления фенол-, мочевино- и меламино-формальдегидных и полиацетатных полимеров, а также бутандиола и метиленбис(4-фенилизоцианата) (МБФИ). Пенопласт на основе МБФИ, например, используется как изолирующий материал для холодильников, дверей, приборных панелей и крыльев легковых автомобилей. Формальдегидные смолы служат, прежде всего, в качестве клеящего состава в деревообрабатывающей промышленности при изготовлении разных строительных материалов — древесностружечных плит, фанеры и деревянных панелей. Конечные продукты на основе производных метанола и направления их применения приведены в табл. 1.

Рис. 1. Химические продукты и материалы, получаемые из метанола
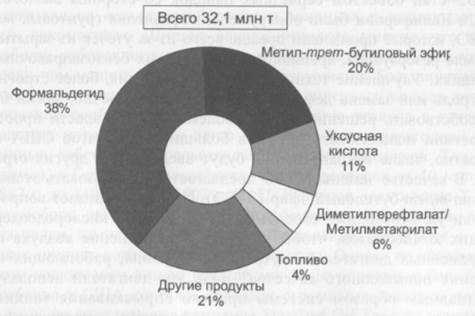
Рис. 2. Мировая потребность в метаноле на 2005 г. [По данным Chemical Week]
Таблица 1
Конечные продукты на основе метанола и типичные направления их применения
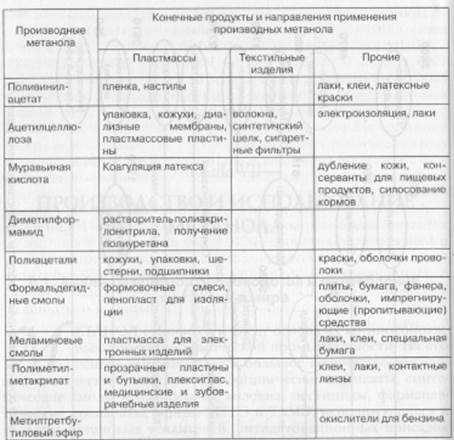
В процессах, применяемых для производства основных химических веществ, 60-70% производственных затрат обычно составляют затраты на сырье. Стоимость сырья поэтому играет существенную экономическую роль. Так, например, в прошлом уксусную кислоту получали главным образом из этилена в вакер-процессе. Однако в начале 1970-х годов фирма Monsanto внедрила процесс карбонилирования метанола. В этом процессе, протекающем в присутствии родийфосфинового катализатора Уилкинсона и иодида (в форме HJ, СН3J или J2), уксусную кислоту получают с выходом и селективностью около 100%. Процесс является высокоэффективным, а метанол обходится дешевле этилена, поэтому большинство вновь строящихся заводов по производству уксусной кислоты во всем мире с тех пор сооружаются с расчетом на эту технологию. С учетом того, что метанол стоит дешевле этилена, его можно рассматривать в качестве потенциального сырья для других процессов, в которых пока используется этилен. Было показано, что катализаторы на основе родия промотируют восстановительное карбонилирование метанола в ацетальдегид с селективностью близкой к 90%. В присутствии добавки рутения как сокатализатора можно проводить более полное восстановление ацетальдегида до этанола, тем самым открывая новый каталитический путь для прямого превращения метанола в этанол. Изучается возможность получения этиленгликоля путем окислительной конденсации метанола, которая может заменить обычный процесс, основанный на использовании этилена в качестве сырья. Имеются значительные успехи в синтезе этиленгликоля из диметилового эфира, полученного путем дегидратации метанола. В будущем метанол можно будет использовать для получения не только уксусной кислоты, ацетальдегида, этанола и этиленгликоля, но также и для крупнотоннажного синтеза других химических веществ, например стирола и этилбензола, которые в настоящее время получают из этилена или пропилена.
Второе место в мире по потреблению метанола занимает производство метил-трет-бутилового эфира (МТБЭ), которыйиспользуется как кислородсодержащая присадка и компонент для смеси с бензином. Спрос на МТБЭ непрерывно рос в течение 1990-е годы, особенно в США, где в 2001 г. на его синтез пошло 37% от всего произведенного метанола. МТБЭ характеризуется большим октановым числом, и поэтому он постепенно стал вытеснять антидетонаторные свинцовые добавки, запрещенные законодательством. При добавке к бензину этого кислородсодержащего компонента легковые автомобили стали меньше загрязнять воздух. Однако в последние годы МТБЭ стал объектом серьезных нападок со стороны экологов. Так, в Калифорнии были обнаружены загрязнения грунтовых вод МТБЭ, которые произошли, прежде всего, из-за утечек из зарытых в земле резервуаров, хранившихся на местных бензозаправочных станциях. Улучшение технического обслуживания, более строгий контроль или замена дефектных резервуаров, конечно, могли бы способствовать решению этой проблемы, однако власти просто запретили использовать МТБЭ в большинстве штатов США и, вероятно, такие же запрещения будут введены и в других странах. В качестве замены МТБЭ предлагается использовать этанол и этил-трет-бутиловый эфир (ЭТБЭ). Правда, возникает вопрос, так ли уж необходимо вводить какие-то добавки кислородсодержащих компонентов, чтобы уменьшить загрязнение воздуха от современных двигателей внутреннего сгорания, работающих на бензине повышенного качества? Ведь эти двигатели используют главным образом системы прямого впрыскивания топлива и датчики кислорода, позволяющие эффективно контролировать и существенно сокращать объемы выбросов даже без присадок кислородсодержащих соединений. Нельзя, конечно, отрицать того, что окислительные добавки обеспечивают эффективное использование и чистоту сгорания топлива. Метанол и полученный из него диметиловый эфир (ДМЭ) отличаются превосходными характеристиками процесса сгорания, которые делают их идеальными топливами для сегодняшних транспортных средств с ДВС и дизельными двигателями. Создание специальной инфраструктуры для метанольных топлив могло бы также способствовать внедрению передовых транспортных средств, работающих на метанольных топливных элементах, но само топливо получают либо конверсией метанола в водород на борту или непосредственно из прямых метанольных топливных элементов (ПМТЭ).
Таким образом, метанол в качестве моторного топлива будет, конечно, играть в будущем все более важную роль.
Похожие статьи:
poznayka.org
